
| 原子序数 | 电子排布式 | 价层电子排布 | 周期 | 族 |
| 49 | ||||
| 1s22s22p6 | ||||
| 3d54s1 | ||||
| 6 | ⅡB |
| 原子序数 | 电子排布式 | 价层电子排布 | 周期 | 族 |
| 1s2 2s22p6 3s23p63d10 4s24p64d10 5s25p1 | 5s25p1 | 5 | ⅢA | |
| 10 | 2s22p6 | 2 | 0 | |
| 24 | 1s2 2s22p6 3s23p63d5 4s1 | 4 | ⅥB | |
| 80 | 1s2 2s22p6 3s23p63d10 4s24p64d10 4f14 5s25p65d106s2 | 4f145d106s2 |


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
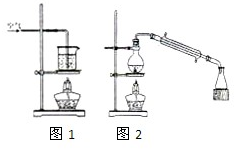 某化学研究小组拟采用铜粉在酸溶液中直接通入空气氧化制备硫酸铜晶体.
某化学研究小组拟采用铜粉在酸溶液中直接通入空气氧化制备硫酸铜晶体.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、前10min反应的平均速率V(C)=0.10mol/L?min |
| B、10min后向容器中加入A,重新平衡时A的转化率一定大于50% |
| C、恒温下将反应容器体积缩小一半,则D的平衡浓度小于1.0mol/L |
| D、反应达平衡时B的平衡浓度是1.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | I1 | I2 | I3 | I4 |
| E | 500 | 4600 | 6900 | 9500 |
| F | 740 | 1500 | 7700 | 10500 |
| H | 580 | 1800 | 2700 | 11600 |
| I | 420 | 3100 | 4400 | 5900 |
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ | |||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com