
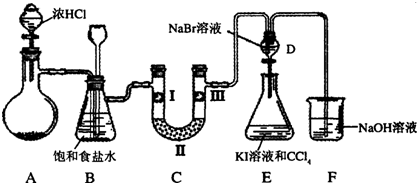
分析 (1)依据氯酸钾和浓盐酸反应的化学方程式结合元素化合价变化计算电子转移;
(2)反应生成物中含有杂质氯化氢、水蒸气,所以饱和食盐水吸收氯化氢气体;长颈漏斗中液面变化情况,来分析整个装置是否堵塞;
(3)验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性;
(4)依据氯气和溴化钠反应现象判断氯气氧化性大于溴单质,打开D装置分液漏斗的活塞,滴入E中溴单质和碘化钾反应生成碘单质,据此设计实验步骤;
(5)F装置是吸收过量的氯气,防止污染空气;
(6)依据亚硫酸钠溶液中 通入氯气反应生成硫酸钠,同时生成的盐酸和亚硫酸钠反应会生成污染气体二氧化硫.
解答 解:(1)若A装置中固体药品为KClO3,和盐酸反应的化学方程式为:KClO3+6HCl=KCl+3Cl2↑+3H2O,反应生成3molCl2,转移电子5mol,则反应中每生成1mol Cl2时转移电子的物质的量为$\frac{5}{3}$,
故答案为:$\frac{5}{3}$;
(2)反应生成物中含有杂质氯化氢、水蒸气,所以饱和食盐水吸收氯化氢气体;长颈漏斗中液面变化情况,来分析整个装置是否堵塞,
故答案为:除去氯气中的氯化氢且能检测实验过程中装置C是否发生堵塞;
(3)装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,选项中abc的Ⅱ中都是干燥剂,再通入湿润的有色布条不能验证氯气的漂白性,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙(硅胶、P2O5),干燥的有色布条,
故答案为:无水氯化钙(硅胶、P2O5);干燥的有色布条;
(4)氯气和溴化钠反应现象判断氯气氧化性大于溴单质,打开D装置分液漏斗的活塞,滴入E中溴单质和碘化钾反应生成碘单质,实验步骤为:打开A中分液漏斗活塞,一段时间后,D中的无色溶液变为橙色(橙红色或黄色),说明氯的非金属性大于溴;打开D中活塞,将D中少量溶液放入装置E中,振荡,下层为紫红色,说明溴的非金属性大于碘,
故答案为:打开A中分液漏斗活塞,一段时间后,D中的无色溶液变为橙色(橙红色或黄色),说明氯的非金属性大于溴;打开D中活塞,将D中少量溶液放入装置E中,振荡,下层为紫红色,说明溴的非金属性大于碘;
(5)F装置是吸收过量的氯气,防止污染空气,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(6)亚硫酸钠溶液中通入氯气反应生成硫酸钠,反应的离子方程式为SO32-+Cl2+H2O=SO42-+2Cl-+2H+,同时生成的盐酸和亚硫酸钠反应会生成污染气体二氧化硫,反应的离子方程式为SO32-+2H+=SO2↑+H2O,
故答案为:SO32-+Cl2+H2O=SO42-+2Cl-+2H+,SO32-+2H+=SO2↑+H2O.
点评 本题考查了实验室制氯气的装置分析,氯气的性质应用,注意装置连接的操作和实验设计,掌握基础是关键,题目难度中等.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:选择题
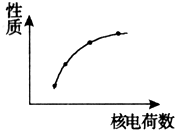 如图表示第IA族的金属元素的某些性质随核电荷数的变化关系.下列各性质中不符合图示关系的是( )
如图表示第IA族的金属元素的某些性质随核电荷数的变化关系.下列各性质中不符合图示关系的是( )| A. | 金属性 | B. | 阳离子的氧化性 | ||
| C. | 单质与水反应的剧烈程度 | D. | 最高价氧化物对应的水化物的碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 54 g Al与足量稀硫酸反应,转移的电子数为6 NA | |
| B. | 标准状况下,1.8 g H2O所占的体积约为2.24 L | |
| C. | 物质的量浓度为0.5 mol•L-1的MgCl2溶液中,含有Cl-个数为NA | |
| D. | 1 mol铁与足量的氯气反应,失去的电子数为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若起始时投入2mol SO2与1mol O2,则生成2mol SO3 | |
| B. | 若用18O2进行反应,则一段时间后,18O在反应物和生成物中均存在 | |
| C. | t min前,该反应的正反应速率大于逆反应速率 | |
| D. | 平衡时反应物与生成物浓度均不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 粒子 | I2 | Br2 | IO3- |
| 物质的量/mol | 0.5 | 1.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态.
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
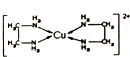 CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写),其结构如图所示.则配离子[Cu(En)2]2+的配位数和该微料含有的微料间的作用力类型均正确的是( )
CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写),其结构如图所示.则配离子[Cu(En)2]2+的配位数和该微料含有的微料间的作用力类型均正确的是( )| A. | 4,配位键、极性键、非极性键 | B. | 2,极性键、非极性键、氢键 | ||
| C. | 4,离子键、配位键、氢键 | D. | 2,配位键、非极性键、极性键、氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
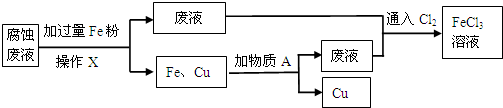
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com