
| A、1﹕1 | B、1﹕2 |
| C、10﹕1 | D、2﹕1 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 500 |


科目:高中化学 来源: 题型:
| 混合物 | 试剂 | 分离方法 | |
| A | 丙烷(乙烯) | KMnO4溶液 | 洗气 |
| B | CH≡CH(H2S) | CuSO4溶液 | 过滤 |
| C | 乙醇(水) | CaO | 蒸馏 |
| D | 苯(乙苯) | KMnO4溶液、NaOH溶液 | 分液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AB |
| B、AB2 |
| C、AB3 |
| D、A2B3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解质在溶液中存在电离平衡状态 |
| B、电离平衡状态时v结合=v电离=0 |
| C、弱电解质溶液中,既存在离子也存在分子 |
| D、电解质的电离是可逆过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O | ||||
| B、Ba(OH)2溶液中逐滴滴加NaHSO4至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | ||||
C、用饱和氯化铁溶液和沸水反应制取氢氧化铁胶体:Fe3++3H2O
| ||||
| D、在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2 Fe(OH)3=2 FeO42-+3Cl-+5H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能够使甲基橙呈现黄色 |
| B、溶液的pH>7 |
| C、溶液中:c(H+)<c(OH-) |
| D、溶液中:c(H+)>1×10-7mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
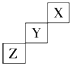 短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法中正确的是( )
短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法中正确的是( )| A、Z可能是活泼金属元素 |
| B、X的最高价氧化物对应的水化物是一种强酸 |
| C、Y元素原子的最外层电子数为7 |
| D、Z的最高价氧化物对应水化物的化学式为HZO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24L H2O含有的分子数等于0.1NA |
| B、常温下,100 mL 1mol/L Na2CO3溶液中钠离子总数为0.1NA |
| C、分子数为NA的CO、N2混合气体体积约为22.4L,质量为28g |
| D、24g O2分子和24g O3分子所含的氧原子数目相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com