
分析 (1)根据M=$\frac{n}{m}$计算Na2X的摩尔质量,钠原子的相对原子质量是23,据此求算X的相对原子质量;
(2)同温同压下,密度之比等于相对分子质量之比,据此计算H2X的相对分子质量,进而计算X的相对原子质量;
(3)结合物质的构成及m=nM计算,1mol的硫酸钠中含有4mol氧原子,1molNaCl中所含有的Na+数为1mol;
(4)同温同压下,体积之比等于物质的量之比,再根据原子守恒确定A的化学式;
(5)根据溶液的浓度和化合物的构成计算溶质离子浓度;
(6)物质的量浓度与溶质的质量分数的转化关系为:c=$\frac{1000ρω}{M}$,将题中数据带入计算出该溶液的物质的量浓度即可;
(7)根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算,摩尔质量在数值上等于其相对原子质量.
解答 解:(1)12.4克Na2X中含有0.4molNa+,Na2X的物质的量为:n(Na2X)=$\frac{1}{2}$n(Na+)=0.4mol×$\frac{1}{2}$=0.2mol,Na2X的摩尔质量为:M(Na2X)=$\frac{12.4g}{0.2mol}$=62g/mol;钠原子的相对原子质量是23,所以X的相对原子质量是62-23×2=16;X为氧原子,该物质的化学式为Na2O,
故答案为:62g/mol;16;
(2)相同状况下,一定体积的气态氢化物H2X的质量是等体积NH3的2倍,则二者密度之比为2:1,同温同压下,密度之比等于相对分子质量之比,H2X的相对分子质量为17×2=34,则X的相对原子质量为34-2=32,
故答案为:32;
(3)0.05mol 的硫酸钠中含有0.05mol×4=0.2molO,个数为0.2NA=1.204×1023(0.2NA),含钠离子为0.05mol×2=0.1mol,与0.1mol×59.5g/mol=5.85gNaCl含相同的钠离子数,
故答案为:1.204×1023(0.2NA);5.85;
(4)同温同压下,体积之比等于物质的量之比,故A、O2和F2的物质的量之比=10:15:10=2:3:2,则该反应方程式为:2A$\frac{\underline{\;\;△\;\;}}{\;}$3O2+2F2,根据原子守恒可知A的化学式为:O3F2,
故答案为:O3F2;
(5)FeCl3在溶液中完全电离,由FeCl3可知,氯离子浓度是FeCl3浓度3倍,所以0.5L 0.5mol/L FeCl3溶液中c(Cl-)=3c(FeCl3)=3×0.5mol/L=1.5mol/L,
故答案为:1.5mol/L;
(6)该硫酸溶液的物质的量浓度为:c=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,故答案为:18.4mol/L;
(7)a个X原子的总质量为b g,则NA个原子的质量为$\frac{b}{a}{N}_{A}$g,即:1molX原子的总质量为$\frac{b}{a}{N}_{A}$g,摩尔质量在数值上等于其相对原子质量,所以X原子相对原子质量为:$\frac{b}{a}{N}_{A}$,
故答案为:$\frac{b}{a}{N}_{A}$.
点评 本题主要考查物质的量的计算,题目难度中等,注意质量守恒定律、摩尔质量在数值上等于其相对分子质量等概念的运用,注意物质的量浓度与溶质质量分数的转化关系,试题侧重对学生能力的培养和解题方法的指导和训练.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 取浸取液少许,滴入AgNO3溶液有白色沉淀产生,则可能含有Cl- | |
| B. | 取浸取液少许,加入Cu和浓H2SO4,试管口有红棕色气体产生,则可能含有NO3- | |
| C. | 取浸取液少许,滴入硝酸酸化的BaCl2溶液,有白色沉淀产生,则一定含SO42- | |
| D. | 用洁净的铂丝棒蘸取浸取液,在酒精灯外焰上灼烧,焰色呈黄色,则一定含有Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 逸出ClO2使生成物浓度降低 | B. | 酸使HClO2的分解加速 | ||
| C. | 溶液中的H+起催化作用 | D. | 溶液中的Cl-起催化作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO对环境的危害在于破坏臭氧层、形成酸雨等方面 | |
| B. | NO可以是某些高价N物质的还原产物也可以是某些含低价N物质的氧化产物 | |
| C. | 实验室制取的NO可以用用排水法和向上排空气法收集 | |
| D. | 生物体内存在少量NO能提高其生理机能,如扩张血管、促进免疫力 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:3 | B. | 1:2:3 | C. | 1:3:3 | D. | 3:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 热化学方程式 | 平衡常数 | |
| 500℃ | 700℃ | |
| ①2H2(g)+CO(g)?CH3OH(g)△H1=a kJ•mol-1 | 2.5 | 0.2 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g)△H2=b kJ•mol-1 | 1.0 | 2.3 |
| ③3H2(g)+CO2 (g)?CH3OH(g)+H2O(g)△H3=c kJ•mol-1 | K3 | 4.6 |
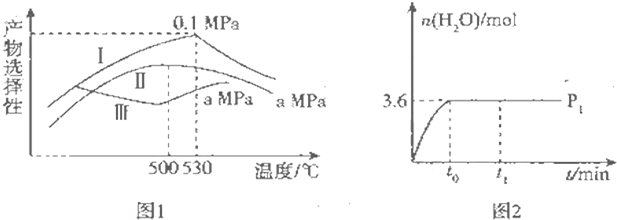
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
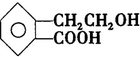 ,它可通过不同化学反应分别制得B、C、D 和E四种物质.
,它可通过不同化学反应分别制得B、C、D 和E四种物质.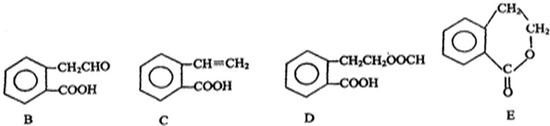
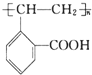 .
.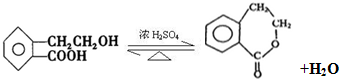 +H2O.
+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com