

·ÖĪö Į׏Æøą”¢Ė®”¢Ģ¼ĖįĒāļ§ŌŚŅ»²½×Ŗ»Æ·“Ó¦Ę÷ÖŠ·“Ó¦CaSO4•2H2O+2NH4HCO3=£ØNH4£©2SO4+CaCO3+CO2”ü+3H2O£¬·“Ó¦ŗó¹żĀĖµĆµ½Ģ¼ĖįøĘŗĶĀĖŅŗĪŖĮņĖįļ§ČÜŅŗ£¬ŌŚČÜŅŗÖŠ¼ÓČėĀČ»Æ¼ŲŌŚĮ½²æ×Ŗ»ÆĘ÷ÖŠ·¢Éś·“Ó¦£ØNH4£©2SO4+2KCl=K2SO4+2NH4Cl£¬¹żĀĖĻ“µÓøÉŌļµĆµ½ĮņĖį¼Ų£¬
£Ø1£©A”¢BĮ½ŅĒĘ÷Ćū³Ę·Ö±šĪŖ£ŗ²¼ŹĻĀ©¶·ŗĶ°²Č«Ę棻
£Ø2£©øł¾ŻĢ¼ĖįĒāļ§µÄŠŌÖŹ·ÖĪö£»
£Ø3£©ĮņĖįļ§ŗĶĀČ»Æ¼Ų·“Ӧɜ³ÉĮņĖį¼ŲŗĶĀČ»Æļ§£»
£Ø4£©ĮņĖį¼ŲŌŚĖ®ÖŠµÄČܽā¶Č“óÓŚŌŚŅŅ¶ž“¼ÖŠµÄČܽā¶Č£»
£Ø5£©ĢśĄė×ÓŗĶĢśĒč»Æ¼ŲČÜŅŗ·“Ӧɜ³ÉKFe[Fe£ØCN£©6]”ż³Įµķ£»
£Ø6£©øł¾ŻÉś³ÉĪļŗĶŌĮĻµÄĄūÓĆĀŹ·ÖĪö£®
½ā“š ½ā£ŗ£Ø1£©A”¢BĮ½ŅĒĘ÷Ćū³Ę·Ö±šĪŖ£ŗ²¼ŹĻĀ©¶·ŗĶ°²Č«Ę棬
¹Ź“š°øĪŖ£ŗ²¼ŹĻĀ©¶·£»°²Č«Ę棻
£Ø2£©Ģ¼ĖįĒāļ§Ņ×·Ö½ā£¬ĪŖ·ĄÖ¹Ģ¼ĖįĒāļ§·Ö½ā£¬ĖłŅŌ·“Ó¦ĪĀ¶Č±ŲŠėµĶÓŚ35”ę£¬
¹Ź“š°øĪŖ£ŗ·ĄÖ¹NH4HCO3·Ö½ā£»
£Ø3£©ĀČ»Æ¼ŲŗĶĮņĖįļ§·“Ӧɜ³ÉĮņĖį¼ŲŗĶĀČ»Æļ§£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗ£ØNH4£©2SO4+2KCl=K2SO4+2NH4Cl£¬
¹Ź“š°øĪŖ£ŗ£ØNH4£©2SO4+2KCl=K2SO4+2NH4Cl£»
£Ø4£©ĮņĖį¼ŲŅ×ČÜÓŚĖ®¶ų²»Ņ×ČÜÓŚŅŅ¶ž“¼£¬ĖłŅŌ¼ÓČėŅŅ¶ž“¼ŹĒĪŖĮĖ½µµĶK2SO4Čܽā¶Č£¬ÓŠĄūÓŚK2SO4Īö³ö£¬Ģįøß²śĀŹ£¬
¹Ź“š°øĪŖ£ŗ½µµĶK2SO4Čܽā¶Č£¬ÓŠĄūÓŚK2SO4Īö³ö£¬Ģįøß²śĀŹ£»
£Ø5£©ĢśĄė×ÓŗĶĢśĒč»Æ¼Ų·“Ӧɜ³ÉKFe[Fe£ØCN£©6]³Įµķ£¬Ęä·“Ó¦·½³ĢŹ½ĪŖ£ŗFe3++K++[Fe£ØCN£©6]4-=KFe[Fe£ØCN£©6]”ż£¬
¹Ź“š°øĪŖ£ŗFe3++K++[Fe£ØCN£©6]4-=KFe[Fe£ØCN£©6]”ż£»
£Ø6£©øĆ·ØÓÅµć³żK2SO4²śĀŹøßĶā£¬»¹ÓŠŌĮĻµĆµ½³ä·ÖĄūÓĆ£¬Ķ¬Ź±µĆµ½ø±²śĘ·»Æ·ŹµČ£¬
¹Ź“š°øĪŖ£ŗŌĮĻµĆµ½³ä·ÖĄūÓĆ£¬Ķ¬Ź±µĆµ½ø±²śĘ·»Æ·ŹµČ£®
µćĘĄ ±¾Ģāæ¼²éĪļÖŹ·ÖĄė”¢ŹµŃ黳±¾²Ł×÷”¢·“Ó¦Ąė×Ó·½³ĢŹ½ŹéŠ“µČ£¬ĢāÄæÄѶČÖŠµČ£¬ĪļÖŹÖʱø·½·ØŗĶĮ÷³Ģ·ÖĪöŹĒ½āĢā¹Ų¼ü



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
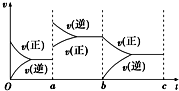 £Ø1£©ÓĆCO2ŗĶĒāĘųŗĻ³ÉCH3OCH3£Ø¼×ĆŃ£©ŹĒ½ā¾öÄÜŌ“Ī£»śµÄŃŠ¾æ·½ĻņÖ®Ņ»£®
£Ø1£©ÓĆCO2ŗĶĒāĘųŗĻ³ÉCH3OCH3£Ø¼×ĆŃ£©ŹĒ½ā¾öÄÜŌ“Ī£»śµÄŃŠ¾æ·½ĻņÖ®Ņ»£®| ŹµŃé ±ąŗÅ | ĪĀ¶Č/”ę | ĘšŹ¼Ź±ĪļÖŹµÄĮæ/mol | Ę½ŗāŹ±ĪļÖŹµÄĮæ/mol | |
| n£ØX£© | n£ØY£© | n£ØM£© | ||
| ¢Ł | 700 | 0.40 | 0.10 | 0.090 |
| ¢Ś | 800 | 0.10 | 0.40 | 0.080 |
| ¢Ū | 800 | 0.20 | 0.30 | a |
| ¢Ü | 900 | 0.10 | 0.15 | b |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® |  ÓĆĶ¼ĖłŹ¾×°ÖĆ³żČ„ŅŅĻ©ÖŠÉŁĮæSO2ĘųĢå | |
| B£® |  ÓĆĶ¼×°ÖĆĮæČ”20.00 mL 0.10 mol•L-1ĮņĖį | |
| C£® |  ÓĆĶ¼ĖłŹ¾×°ÖĆæÉ·ÖĄėCH3COOC2H5ŗĶ±„ŗĶĢ¼ĖįÄĘČÜŅŗ | |
| D£® |  ÓĆĶ¼×°ÖĆÖʱøFe£ØOH£©2²¢ÄܽĻ³¤Ź±¼ä¹Ū²ģĘäŃÕÉ« |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
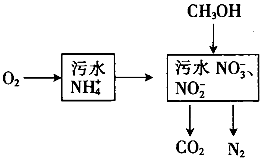 “¦ĄķÉś»īĪŪĖ®ÖŠµÄNH4+£¬¹ż³ĢČēĻĀ£ŗ
“¦ĄķÉś»īĪŪĖ®ÖŠµÄNH4+£¬¹ż³ĢČēĻĀ£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | SO2ŗĶC12¶¼ÄÜÓĆÓŚĘÆ°× | B£® | ±½·Ó”¢ŅŅĻ©¶¼ÄÜøśäåĖ®·“Ó¦ | ||
| C£® | ĖÕ“ņ”¢Š”ĖÕ“ņĖ®ČÜŅŗµÄpH¶¼“óÓŚ7 | D£® | I2£¬NH4Cl¾§ĢåŹÜČȶ¼Öš½„ĻūŹ§ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ³£ĪĀ³£Ń¹ĻĀ£¬44g±ūĶéŗ¬ÓŠ¹²¼Ū¼üµÄŹżÄæĪŖ10NA | |
| B£® | 1 L 1 mol•L-1µÄNa2CO3ČÜŅŗÖŠŗ¬ÓŠŃõŌ×ӵďżÄæĪŖ3NA | |
| C£® | ³£ĪĀ³£Ń¹ĻĀ£¬11.2LÓÉN2ÓėCO×é³ÉµÄ»ģŗĻĘųĢåŗ¬ÓŠµÄŌ×ÓŹżÄæĪŖNA | |
| D£® | ±ź×¼×“æöĻĀ£¬6.72 L NO2ČÜÓŚ×ćĮæµÄĖ®ÖŠ£¬×ŖŅʵē×ӵďżÄæĪŖ0.3NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Cl2ÓėI2Éś³ÉIClŹĒ·ĒŃõ»Æ»¹Ō·“Ó¦ | |
| B£® | ·“Ó¦¢ŁÖŠ£¬ĆæÉś³É1 mol ZnCl2Ź±×ŖŅĘ2molµē×Ó | |
| C£® | ·“Ó¦¢ŁÖŠ£¬ZnI2¼ČŹĒŃõ»Æ²śĪļÓÖŹĒ»¹Ō²śĪļ | |
| D£® | ·“Ó¦¢ŚÖŠ£¬ICl¼ČŹĒŃõ»Æ¼ĮÓÖŹĒ»¹Ō¼Į |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ½«pH=4µÄijĖįĻ”ŹĶ10±¶£¬²āµĆĘäpH£¼5£¬ŌņøĆĖįĪŖČõĖį | |
| B£® | ĻąĶ¬ĪĀ¶ČĻąĶ¬pHµÄCH3COONa”¢NaAlO2ŗĶNaHCO3ČżÖÖČÜŅŗµÄĪļÖŹµÄĮæÅØ¶Č“óŠ”ĪŖ£ŗc£ØNaAlO2£©£¼c£ØNaHCO3£©£¼c£ØCH3COONa£© | |
| C£® | 0.1 mol/LµÄNaAČÜŅŗŗĶ0.1 mol/LµÄHAČÜŅŗµČĢå»ż»ģŗĻpH=4.75£¬ŌņČÜŅŗ£ŗc £ØHA£©+2c£ØH+£©=2c£ØOH-£©+c£ØA-£© | |
| D£® | ĻņNH4HSO4ČÜŅŗÖŠµĪ¼ÓNaOHČÜŅŗÖĮÖŠŠŌ£¬ĖłµĆ»ģŗĻŅŗ£ŗc£ØNa+£©£¾c£ØNH4+£©£¾c£ØSO42-£©£¾c£ØOH-£©=c£ØH+£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÉĻŹö·“Ó¦¾łĪŖŃõ»Æ»¹Ō·“Ó¦ | |
| B£® | ·“Ó¦¢Ł”¢¢ŚÖŠŃõ»Æ¼Į¶¼ŹĒŃõĘų | |
| C£® | ÓėĶÖŹĖ®ĮśĶ·Į¬½Ó“¦µÄøÖÖŹĖ®¹ÜŅ×·¢ÉśøÆŹ“ | |
| D£® | øÖĢśŌŚ³±ŹŖµÄæÕĘųÖŠĶس£·¢ÉśĪüŃõøÆŹ“ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com