
分析 已知CO(g)+$\frac{1}{2}$O2(g)?CO2(g)△H=-141kJ•mol-1 ①
2H2(g)+O2(g)?2H2O(g)△H=-484kJ•mol-1 ②
CH3OH(l)+$\frac{3}{2}$O2(g)?CO2(g)+2H2O(g)△Hl=-726kJ•mol-1 ③
依据盖斯定律①+②-③得到依据热化学方程式.
解答 解:已知CO(g)+$\frac{1}{2}$O2(g)?CO2(g)△H=-141kJ•mol-1 ①
2H2(g)+O2(g)?2H2O(g)△H=-484kJ•mol-1 ②
CH3OH(l)+$\frac{3}{2}$O2(g)?CO2(g)+2H2O(g)△Hl=-726kJ•mol-1 ③
依据盖斯定律①+②-③得到CO、H2化合制得液态甲醇的热化学方程式:CO(g)+2H2(g)=CH3OH(l)△H=+101 kJ/mol,
故答案为:CO(g)+2H2(g)=CH3OH(l)△H=+101 kJ/mol.
点评 本题考查热化学方程式的书写和盖斯定律的应用,学生要知道热化学方程式是表示化学反应与反应热关系的方程式,比较容易.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
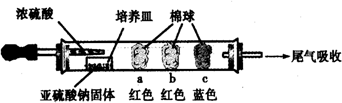
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | 品红试液 | 棉球变白,微热后又恢复红色 | SO2具有漂白性,且为暂时性漂白 |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式:2OHˉ+SO2 =SO32ˉ+H2O或OHˉ+SO2=HSO3ˉ |
| c | 含淀粉的碘水 | 棉球变为白色 | 该气体具有还原性 (选填“氧化性”或“还原性”) |
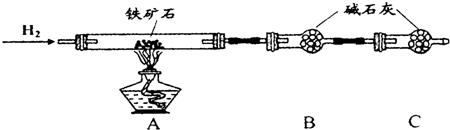
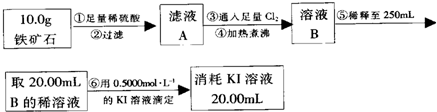
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲原子最外层电子数比乙原子最外层电子数少 | |
| B. | 甲原子电子层数比乙原子电子层数多 | |
| C. | 1mol甲从酸中置换生成的氢气比1mol乙从酸中置换生成的氢气多 | |
| D. | 常温下,甲能与水反应生成氢气,而乙不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
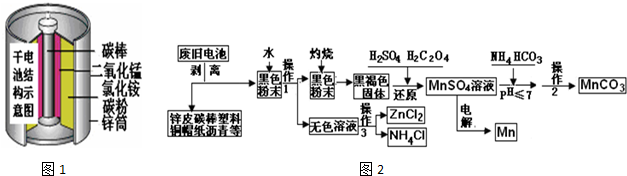
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{7}{4}g$ | B. | 4.7 g | C. | 7.4 g | D. | $\frac{4}{7}g$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所涉及的物质均为中学化学中的常见物质,其中C、D、E为单质,其余为化合物,F为磁性物质.它们存在如下转化关系,反应中生成的水及次要产物均已略去.
如图所涉及的物质均为中学化学中的常见物质,其中C、D、E为单质,其余为化合物,F为磁性物质.它们存在如下转化关系,反应中生成的水及次要产物均已略去.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁均有水珠 | 两种物质均受热分解 |
| B | 向滴有酚酞的NaOH溶液中 通入SO2 | 溶液红色褪去 | SO2具有漂白性 |
| C | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Cl2>I2 |
| D | 向FeSO4溶液中先滴入KSCN溶液,再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参与反应的硫酸少于0.18mol | B. | 有0.12mol H2SO4被还原 | ||
| C. | 反应后溶液中无H2SO4剩余 | D. | 消耗锌片为7.8g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com