
【题目】金属(M)-空气电池的工作原理如图所示,下列说法不正确的是( )
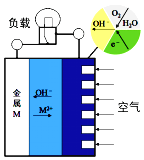
A. 金属M作电池负极
B. M2+移向金属(M)电极
C. 正极的电极反应为O2+4e-+2H2O=4OH-
D. 电池反应为2M+O2+2H2O=2M(OH)2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列关于实验安全说法正确的是( )
A.少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶支管口处
C.实验室可用燃着的酒精灯去点燃另一只酒精灯
D.将含硫酸的废液倒入水槽,用水冲入下水道
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g) 在不同温度下的平衡常数如表:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 42.9 | 50.7 | 64.0 |
请回答下列问题:
(1)该反应的平衡常数表达式 K= ,△H 0(填“>”、“<”或“=”)。
(2)在一个容积为10L的密闭容器中,1300℃时加入 Fe、Fe2O3、CO、CO2各1mol , 反应经过10min 后达到平衡.求该时间范围内反应的平均反应速率 v(CO2)= ,CO 的平衡转化率为 。
(3)欲提高(2)中CO的平衡转化率,可采取的措施是 ______。
A.增加Fe2O3的量
B.加入合适的催化剂
C.移出部分CO2
D.提高反应温度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K时,Ksp(NiS)=1.0×10-21,Ksp(NiCO3)=1.0×10-7 ;p(Ni)=-lg c(Ni2+),p(B)=-lg c(S2-)或-lg c(CO32-)。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。下列说法错误的是
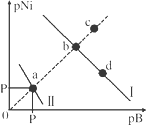
A. 常温下NiCO3的溶解度大于NiS的溶解度
B. 向d点对应的溶液中加入对应阴离子的钠盐,d点向b点移动
C. 对于曲线I,在b点加热,b点向c点移动
D. P为3.5且对应的阴离子是CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷精矿粉酸浸时发生反应:2Ca5(PO4)3(OH)+3H2O+10H2SO4![]() 10CaSO4·0.5H2O+6H3PO4。有关说法正确的是( )
10CaSO4·0.5H2O+6H3PO4。有关说法正确的是( )
A. 该反应属于氧化还原反应
B. 硫酸酸性比磷酸强
C. Ca5(PO4)3(OH)是牙釉质的主要成分,易溶于水
D. S、P同主族,S的非金属性更强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为探究铁发生电化学腐蚀的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化(结果如图2).下列叙述错误的是( )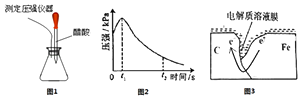
A.图2中,t2时容器中压强明显小于起始压强是因为铁粉发生了吸氧腐蚀
B.碳粉表面的电极反应式只有:2H2O+O2+4e﹣═4OH﹣
C.碳粉表面一定发生了还原反应
D.图3中,发生腐蚀时电子转移方向如箭头所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2L的密闭容器中发生2SO2+O22SO3反应,现控制下列三种不同的条件:①在400℃时,10molSO2与5molO2反应;
②在400℃时,20molSO2与5molO2反应;
③在300℃时,10molSO2与5molO2反应;
(1)开始时,化学反应速率快慢顺序是;
(2)若10min内测得第①组的平均反应速率为:V(SO2)=0.4mol/(Lmin),则V(O2)= , 10min时,SO3浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是(△H的绝对值均正确)( )
A.C(s)+ ![]() O2(g)═CO(g)△H=﹣110.5KJmol﹣1(燃烧热)
O2(g)═CO(g)△H=﹣110.5KJmol﹣1(燃烧热)
B.C2H5OH+3O2═2CO2+3H2O△H=﹣1368.8KJmol﹣1(反应热)
C.2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O (l)△H=﹣114.6KJmol﹣1(中和热)
D.2H2O(g)═2H2(g)+O2(g)△H=+483.6KJmol﹣1(反应热)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com