
| A. | V=2240 | |
| B. | n=0.02 | |
| C. | 原混合物中FeS04的质量分数约为89% | |
| D. | m=0.6 |
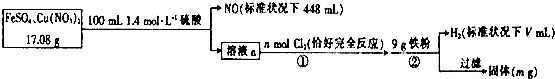
分析 根据题中流程可知,步骤②中加入铁粉产生了氢气,说明前面的酸过量,步骤①中有氯气与亚铁离子反应,说明溶液a中有亚铁离子,17.08g的FeS04和Cu(N03)2的混合物与0.14mol硫酸混合,由于亚铁离子过量,硝酸根全部被还原为NO,据此计算得硝酸铜的质量及消耗掉的氢离子的物质的量,同时根电子得失守恒可计算出溶液a中生成的铁离子的物质的量,根据氯气的物质的量可计算出a溶液中亚铁离子的物质的量,并由此计算出溶液中铁离子的总物质的量,根据溶液中的氢离子及9g铁粉可计算出氢气的体积和m的值.
解答 解:根据题中流程可知,步骤②中加入铁粉产生了氢气,说明前面的酸过量,步骤①中有氯气与亚铁离子反应,说明溶液a中有亚铁离子,17.08g的FeS04和Cu(N03)2的混合物与0.14mol硫酸混合,硝酸根全部被还原为NO,NO的物质的量为$\frac{0.448L}{22.4L/mol}$mol=0.02mol,根据氮元素守恒,样品中Cu(N03)2的质量为188g/mol×0.01mol=1.88g,所以FeS04的质量为17.08g-1.88g=15.2g,其物质的量为0.1mol,原混合物中FeS04的质量分数为$\frac{15.2g}{17.08}$×100%=89%,
根据方程式3Fe2++8H++2NO3-(稀)═3Fe3++2NO?+4H2O
3mol 8mol 2×22.4L
n(Fe2+) n(H+) 448mL
所以n(Fe2+)=0.03mol,n(H+)=0.08mol,则a溶液中亚铁离子的物质的量为0.1mol-0.03mol=0.07mol,
根据方程式2Fe2++Cl2═2Fe3++2Cl-,可得氧化亚铁离子需要氯气的物质的量为0.035mol,
根据铁元素守恒,a溶液中铁离子的物质的量为0.1mol,根据反应2Fe3++Fe═3Fe2+,可得消耗铁的物质的量为0.05mol即质量为2.8g,a溶液中n(H+)=0.14mol×2-0.08mol=0.2mol,结合反应2H++Fe═H2↑+Fe2+,可得消耗铁的物质的量为0.1mol即质量为5.6g,则剩余铁的质量为9g-5.6g-2.8g=0.6g,
生成的氢气为0.1mol,其体积为2.44L,
由以上分析可知V=2240、原混合物中FeS04的质量分数约为89%、m=0.6,
故选B.
点评 本题考查了化学计算与实验流程相结合的知识,为高频考点,侧重于学生的分析、计算能力的考查,根据实验步骤和实验现象进行逐步计算是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Ba2+→Ag+→H+ | B. | Ag+→Ba2+→H+ | C. | H+→Ba2+→Ag+ | D. | H+→Ag+→Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| B. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| C. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| D. | 加入KSCN溶液,出现血红色,一定不含Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol•L-1 | B. | 0.4 mol•L-1 | C. | 0.6 mol•L-1 | D. | 0.8 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
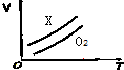 如图表示ag O2与a gX气体在恒压条件下的密闭容器中体积(V)与温度(T)的关系,则X气体可能是( )
如图表示ag O2与a gX气体在恒压条件下的密闭容器中体积(V)与温度(T)的关系,则X气体可能是( )| A. | C3H6(气) | B. | CH4 | C. | CO2 | D. | NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
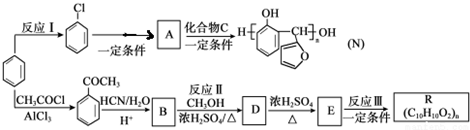
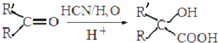
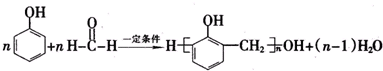
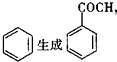 的反应类型是取代反应,D生成E的过程中,浓硫酸的作用是催化剂和脱水剂•
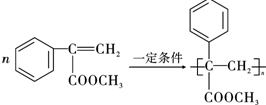
的反应类型是取代反应,D生成E的过程中,浓硫酸的作用是催化剂和脱水剂•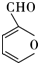
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
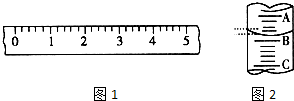 (1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在下表中填空,表示称量过程,并在图1所示的游码尺上画出游码的位置(画“|”表示).
(1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在下表中填空,表示称量过程,并在图1所示的游码尺上画出游码的位置(画“|”表示).| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 取用砝码情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡前,充入氮气,容器内压强增大,反应速率加快 | |
| B. | 平衡时,其他条件不变,分离出硫,逆反应速率减小 | |
| C. | 平衡时,其他条件不变,升高温度可提高 SO2 的转化率 | |
| D. | 其他条件不变,缩小容器体积,平衡正反应方向移动,该反应的平衡常数不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com