
【题目】2SO2(g) + O2(g) ![]() 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中,正确的是
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中,正确的是
甲 | 乙 | 丙 | ||
起始物质的量 | n(SO2) / mol | 0.4 | 0.8 | 0.8 |
n(O2) / mol | 0.24 | 0.24 | 0.48 | |
SO2的平衡转化率 / % | 80 | α1 | α2 | |
A. 甲中反应的平衡常数小于乙
B. 平衡时,丙中c(SO3)是甲中的2倍
C. 该温度下,平衡常数值为400
D. 平衡时,甲中O2的转化率大于乙中O2的转化率
【答案】C
【解析】
A.温度相同时,该反应的平衡常数不变,则甲、乙中反应的平衡常数相等,故A错误;
B.体积相同,丙中的起始浓度为甲的2倍,但由于该反应是气体体积改变的反应,体积不变增加浓度,压强增大,平衡正向移动,则丙中转化率增大,即丙中c(SO3)大于甲中c(SO3)的2倍,故B错误;
C.根据 2SO2(g)+O2(g)2SO3(g),
开始(mol) 0.4 0.24 0
转化(mol) 0.32 0.16 0.32
平衡(mol) 0.08 0.08 0.32
平衡浓度(mol/L)0.04 0.04 0.16
所以该温度下,平衡常数值K=![]() =400,故C正确;
=400,故C正确;
D.由甲、乙可知,氧气的浓度相同,乙中二氧化硫的浓度增大会促进氧气的转化,甲中O2的转化率小于乙中O2的转化率,故D错误;故选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.我国的青海省有许多盐湖盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用。粗盐中含Ca2+、Mg2+、SO42-以及泥沙等杂质,为了除去可溶性杂质,有以下实验步骤进行提纯:
①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。
(1)以下操作顺序不合理的是 _______。
A.②⑤④③① B.④⑤②①③ C.⑤②④①③ D.⑤④②①③
(2)用提纯的NaCl配制450 mL 4.00 mol·L-1NaCl溶液,所用仪器除天平、药匙、烧杯、玻璃棒外还有________(填仪器名称)。
(3)通过步骤①中过滤后的滤液,检验SO42-是否除尽的操作方法是_________________________
Ⅱ.向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入2.0 mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。回答下列问题:
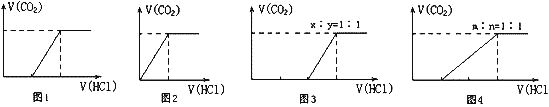
(1)图1中通入CO2后所得溶液的溶质成分为____________________;
(2)图3中通入CO2后所得溶液的溶质成分为____________________。
Ⅲ.已知氮化镁极易与水反应:Mg3N2+6H2O===2NH3↑+3Mg(OH)2↓。将足量的镁条置于空气燃烧,可能会发生下列反应①2Mg+O2![]() 2MgO;②3Mg+N2
2MgO;②3Mg+N2![]() Mg3N2;③2Mg+CO2
Mg3N2;③2Mg+CO2![]() 2MgO+C;④Mg+H2O(g)
2MgO+C;④Mg+H2O(g)![]() MgO+H2。请设计一个实验,验证产物中含有氮化镁(Mg3N2):_________________________。
MgO+H2。请设计一个实验,验证产物中含有氮化镁(Mg3N2):_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑨九种元素,填写下列空白:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
一 | ① | |||||||
二 | ② | ③ | ④ | |||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
四 | ⑨ |
(1)在这些元素中,金属性最强的是________(填具体元素符号,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是________。
(3)最高价氧化物是两性氧化物的元素是________;写出它的氧化物与氢氧化钠反应的离子方程式___________________________________________________________。
(4)③④⑤对应的简单离子半径由小到大的顺序为:______________。
(5)①与③可形成一种18 e- 的分子,写出该分子的电子式:__________,该分子中存在________(填“极性键”或“非极性键”或“离子键”)。
(6)①与⑤形成的化合物可与水反应生成一种无色气体,当转移0.5mol电子时,生成的气体在标准状况下的体积为______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水资源开发利用的部分过程如下图所示(苦卤中主要含 K+、Mg2+、Br-等),下列说法错误的是

A. 从海水得到粗盐主要通过蒸发操作实现
B. 向苦卤中通入 Cl2 时溴离子被还原为 Br2
C. 富集溴涉及的离子反应有 Br2+SO2+2H2O==2Br-+4H++SO42-
D. 工业选用的沉淀剂通常经煅烧碳酸钙获得而不是电解食盐水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表示下列反应的离子方程式正确的是
A. 在强碱性溶液中次氯酸钠与 Fe(OH)3 反应生成 Na2FeO4: 3ClO3-+2Fe(OH)3 =2FeO42-+3Cl-+H2 O+4H+
B. 用浓盐酸与 MnO2 反应制取少量氯气:MnO2+2H++2Cl-= Mn2++Cl2↑+2H2O
C. 向 NaAlO2 溶液中通入过量 CO2 制 Al(OH)3:AlO2-+CO2+2H2O===Al(OH)3↓+HCO3-
D. 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-===3Fe3++NO2↑+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d 四种物质之间的转化关系如图所示(部分产物略去),下列说法正确的是

A. 若 a 为 Cl2,b 可能为 NH3,实验室可用加热固体 c 的方法制取 NH3
B. 若 a 为 Fe,b 可能为稀 HNO3,反应②的离子方程式为3Fe+8H++2NO3-===3Fe2++2NO2↑+4H2O
C. 若 a 为 AlCl3 溶液,b 可能为氨水,反应①的离子方程式为Al3++4NH3 ·H2O===AlO2-+4NH4++2H2O
D. 若 a 为 NaOH 溶液,b 可能为 CO2,可用 Ca(OH)2 溶液鉴定 c、d 溶液中的阴离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列判断正确的是

A. a为负极、b为正极
B. 电解过程中,c电极上发生氧化反应
C. d为阳极,电极反应为:2Cl―2e-=Cl2↑
D. 电解过程中,化学能转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅及其化合物的说法正确的是
A.硅在自然界中以游离态和化合态两种形式存在
B.硅晶体是良好的半导体,可用于制造光导纤维
C.木材浸过水玻璃后,不易着火
D.SiO2是酸性氧化物,不与任何酸发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述及解释正确的是
A. 2NO2(g)(红棕色)![]() N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
B. H2(g)+I2(g)![]() 2HI(g) ΔH<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变
2HI(g) ΔH<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变
C. FeCl3+3KSCN![]() Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
D. 对于N2+3H2![]() 2NH3,平衡后,压强不变,充入O2,平衡左移
2NH3,平衡后,压强不变,充入O2,平衡左移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com