
| A | B | C | D | |
| 污染 | 废旧热固性塑料 | 煤燃烧 | 含Hg2+的工业废水 | 生活垃圾 |
| 方法 | 粉碎作为填充剂 | 煤中加入适量石灰石 | 加入Na2S溶液 | 焚烧发电 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.粉碎塑料没有新物质生成;
B.石灰石与煤燃烧时产生的SO2及空气中的O2反应,生成CaSO4和CO2;
C.含Hg2+的工业废水加入Na2S溶液反应生成硫化汞沉淀;
D.焚烧发电有新物质生成.
解答 解:A.粉碎塑料没有新物质生成,属于物理变化,故A错误;
B.石灰石与煤燃烧时产生的SO2及空气中的O2反应,生成CaSO4和CO2,有新物质生成,属于化学变化,故B正确;
C.含Hg2+的工业废水加入Na2S溶液反应生成硫化汞沉淀,有新物质生成,属于化学变化,故C正确;
D.焚烧发电有新物质生成,属于化学变化,故D正确.
故选A.
点评 本考点考查了物理变化和化学变化的区别,基础性比较强,只要抓住关键点:是否有新物质生成,问题就很容易解决.本考点主要出现在选择题和填空题中.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原性二糖 | |
| B. | 室温下,将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合(忽略体积的变化)测得混合溶液的pH=5,则混合溶液中由水电离出的c(H+)=1×10-5mol/L | |
| C. | 纯碳新材料“碳纳米泡沫”,每个泡沫含有约4000个碳原子,直径约6到9nm,在低于-183℃时,泡沫具有永久磁性,“碳纳米泡沫”与石墨互为同素异形体 | |
| D. | 已知 Ag2CrO4的Ksp为1.12×10-12,则将等体积的1×10-4 mol•L-1的AgNO3溶液和1×10-4 mol•L-1 K2CrO4溶液混合后会有Ag2CrO4沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
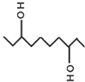
| A. | 该有机物的分子式为C10H20O2 | |
| B. | 该有机物与乙二醇、甘油互为同系物 | |
| C. | 1mol该有机物一定条件下与Na完全反应最多可生成22.4L氢气 | |
| D. | 该有机物一定条件下,可以发生取代、氧化、酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
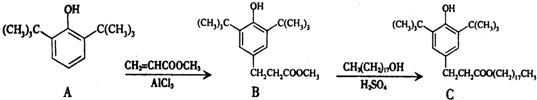
| A. | 物质A是苯甲醇的同系物 | |
| B. | 物质B能发生取代、加聚等反应 | |
| C. | 可用氯化铁溶液鉴别物质C中是否含有CH3(CH2)17OH杂质 | |
| D. | 1 mol物质C与足量NaOH溶液反应,最多可消耗2 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
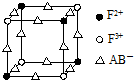 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子.
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 丙中一定含有羧基 | B. | 甲不可以与HBr发生取代反应 | ||
| C. | 甲、乙、丙都能发生氧化反应 | D. | 可以用溴水检验乙中的碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
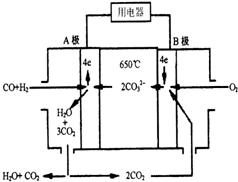 现有一个碳酸盐燃料电池,以一定比例的Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,直接以水煤气(CO、H2的体积比为1:1)为燃料,其工作原理如图所示.
现有一个碳酸盐燃料电池,以一定比例的Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,直接以水煤气(CO、H2的体积比为1:1)为燃料,其工作原理如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com