
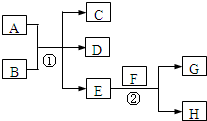
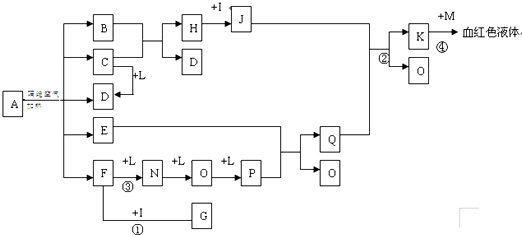
 ��֪������EΪ��ɫ��ζ��Һ�壬FΪ����ɫ��ĩ��GΪ��������ɫ���壨��Ӧ���������ԣ�����ش��������⣺
��֪������EΪ��ɫ��ζ��Һ�壬FΪ����ɫ��ĩ��GΪ��������ɫ���壨��Ӧ���������ԣ�����ش��������⣺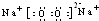 ��
��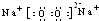 ��0.2NA��1.024��1023��
��0.2NA��1.024��1023�� CaCl2+2H2O+2NH3����
CaCl2+2H2O+2NH3���� CaCl2+2H2O+2NH3����4NH3��g��+5O2��g��=4NO��g��+6H2O��g����H=-906.8KJ/mol��
CaCl2+2H2O+2NH3����4NH3��g��+5O2��g��=4NO��g��+6H2O��g����H=-906.8KJ/mol��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 CH3CHO+H2O+Cu
CH3CHO+H2O+Cu CH3CHO+H2O+Cu
CH3CHO+H2O+Cu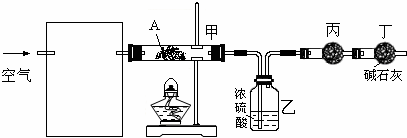
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
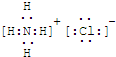
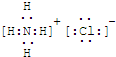
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�����ʡ�����и�����ҵ��������飨�������ۻ�ѧ�Ծ��������棩 ���ͣ������
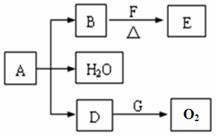
��ͼ��ʾ������֮���ת����ϵ����֪D��E��Z����ѧ��ѧ�����ĵ��ʣ��������ǻ����Z��Y���ȼҵ�IJ�Ʒ��DԪ�ص�ԭ����������������Ӳ�����ȣ���D�������ο�����ˮ����EΪ�ճ�������Ӧ����㷺�Ľ���������Ӧ���⣬������Ӧ����ˮ��Һ�н��С���ش��������⡣

��1��д��X�ĵ���ʽ��??????????? ��
��2������ʱpH =12��G��Һ�У����ʵ������������ʵ�������Ũ��֮��Ϊ?????????? ��д������ʽ����
��3���ڵ�ƹ�ҵ�У�����E��Ϊ���ƽ�����ͭΪ�Ʋ��������ͭ��____������д����E�缫�Ϸ����ĵ缫��Ӧʽ��????????????? ��
��4��д����Ӧ�������ӷ���ʽ��??????????????????? ��
��5�������ޱ�ǩ��Y��M��������ɫˮ��Һ�����������κ��Լ����������һ����ʵ�����������Һ���Լ���???????????????? ���ش�ʵ������������ۣ���
��6��A��Һ��NaOH��Һ��Ͽ��γɳ�����ij�¶��´˳�����Ksp =2.097��l0��39����0.01 mol/L��A��Һ��0.001 mol��L��1��NaOH��Һ�������ϣ�����Ϊ�ܷ��γɳ���____��������������������������ͨ������˵��????????????????????????????? ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ���㽭ʡ������ʮУ����3���������ۻ�ѧ�Ծ��������棩 ���ͣ������
2013��10��������̨��������ܵ��ش���ʧ���м������Ľ����ɹ�����ҩƷ���������ֺ���Ҫ�����������������������и�Ч���������̼�����������Ҫ�ɷ�H2O2��һ����ɫճ��Һ�壬��ش��������⣺
��1�����з�����H2O2�����ֵ��������������Ϊ��������ȫһ�µ���??????? ��
A��BaO2+2HCl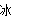 H2O2+BaCl2
H2O2+BaCl2
B��Ag2O+H2O2 =2Ag+O2+H2O???
C��2H2O2 2H2O+O2��
2H2O+O2��
D��H2O2+NaCrO2+NaOH=Na2CrO4 +H2O
��2��������䳣��Һ̬��(N2H4)Ϊȼ�ϣ�Һ̬H2O2Ϊ��ȼ������֪��
N2H4��1��+O2(g)=N2(g)+2H2O(g)? ��H= - 534 kJ��mol��1???
H2O2��1��=H2O��1��+1/2O2(g)? ��H= - 98.64 kJ��mol��1
H2O��1��=H2O(g)? ��H=+44kJ��mol��l
��ӦN2H4��1��+2H2O2��1��=N2(g)+4H2O(g)����H=?????????? ��
�÷�Ӧ����S=??????? 0(������������<��)��
��3��H2O2��һ�ֲ��ȶ��ֽ�����ʡ�
����ͼ��H2O2��û�д���ʱ��Ӧ�����������仯ͼ������ͼ�ϻ���ʹ�ô����ӿ�ֽ�����ʱ���������ͼ

��ʵ��֤ʵ����Na2CO3��Һ�м���H2O2Ҳ�������ݲ�������֪����ʱH2CO3�ĵ��볣���ֱ�ΪKal=4.3��l0��7��Ka2 = 5.0 ��l0��11 ��Na2CO3��Һ��CO32����һ��ˮ�ⳣ������ʽKhl=????? ������ʱKhl��ֵΪ??????????? ������Na2CO3��Һ��ͬʱ��������Na2CO3�������ʵ�������Һ�¶ȣ���Khl��ֵ
?????????? (����С�������ȷ��)��
��4��ij���ױ����˲�ͬ�������Ӽ���Ũ�ȶ�˫��ˮ�������⺣��������Һ��Ӧ���ʵ�Ӱ�죬ʵ������ͼ1��ͼ2��ʾ��

ע������ʵ������¶�Ϊ20����w(H2O2)=0��25%��pH=7��12������������ҺŨ��Ϊ8mg��L-l�������½��С�ͼ1������a��H2O2��b��H2O2+Cu2+��c��H2O2+Fe2+��d��H2O2+Zn2+��e��H2O2+Mn2+��ͼ2������f����Ӧʱ��Ϊ1h��g����Ӧʱ��Ϊ2h����ͼ�е��������������������Һ��ճ��(��������Ũ������Һճ�������)��
��������Ϣ��֪�����������������????????????????? (�����)��
A����������ʹ�ý��ⷴӦ���ʼ���
B���������ӶԸý��ⷴӦ�Ĵ�Ч�ʱ�ͭ���ӵ�??????
C������������Һճ�ȵı仯�����ɷ�ӳ���併�ⷴӦ���ʵĿ���?????
D��һ�������£�ͭ����Ũ��һ��ʱ����Ӧʱ��Խ��������������ҺŨ��ԽС
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com