
【题目】在一密闭容器中,反应aA(气)![]() bB(气)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新平衡时,B的浓度是原来的60%,则
bB(气)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新平衡时,B的浓度是原来的60%,则
A. 平衡向逆反应方向移动了 B. 物质A的转化率减小了
C. 物质B的质量分数增加了 D. a>b
科目:高中化学 来源: 题型:
【题目】能源、资源问题是当前人类社会面临的一项重大课题。
(1)直接利用物质燃烧提供热能在当今社会仍然占很大比重,但存在利用率低的问题。CH4、H2、CO、CH3OH都是重要的能源物质,甲烷燃烧的化学方程式为:____。
(2)燃料电池将能量转化效率比直接燃烧效率高,如图为某种燃料电池的工作原理示意图,a、b均为惰性电极。

①使用时,空气从____口通入(填“A”或“B”);
②假设使用的“燃料”是甲醇,a极的电极反应式为:____。
(3)钢铁的腐蚀现象非常普遍,电化学腐蚀是造成钢铁腐蚀的主要原因,某同学按下图进行钢铁腐蚀的模拟,则正极的电极反应式为:____,当导线中有3.01×1023个电子流过,被腐蚀的铁元素为____g。[ 提示:电化学的总反应式为2Fe+2H2O+O2=2Fe(OH)2]

(4)海水化学资源的开发利用具有重要的意义和作用,下图是海带中提取碘的示意图:

①中操作的名称是____;反应②的离子方程式是____,下述物质中不可做试剂③的是____。
A.乙醇 B.苯 C.乙酸 D.四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为光伏发电电解甲基肼[CH3-NH-NH2]制氢的装置示意图(电解池中交换膜仅阻止气体通过,a、b极均为惰性电极)。下列叙述中正确的是

A. N型半导体为正极,P型半导体为负极
B. 制氢装置溶液中电子从a极流向b极
C. 工作时,产生的N2、H2体积比为1:3(同温同压)
D. 工作时,a极的电极反应式为CH3-NH-NH2+12OHˉ-10eˉ=CO32-+N2↑+9H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用苯和1,2—二氯乙烷制联苄的反应原理如下
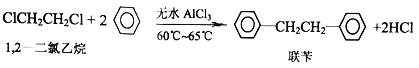
实验室制取联苄的装置如图所示(加热和夹持仪器略去)
实验步骤:
①在三颈烧瓶中加入120.0mL苯和适量无水AlCl3,由滴液漏斗滴加10.0mL 1,2-二氯乙烷,控制反应温度在60~65℃,反应约60min。
②将反应后的混合物依次用2%Na2CO3溶液和水洗涤,在所得产物中加入少量无水MgSO4固体,静置、过滤,蒸馏收集一定温度下的馏分,得联苄18.2g。
相关物理常数和物理性质如下表:
名称 | 相对分子质量 | 密度/g·cm-3 | 熔点/℃ | 沸点/℃ | 溶解性 |
苯 | 78 | 0.88 | 5.5 | 80.1 | 难溶于水,易溶于乙醇 |
1,2-二氯乙烷 | 99 | 1.27 | -35.3 | 83.5 | 难溶于水,可溶于苯 |
联苄 | 182 | 0.98 | 52 | 284 | 难溶于水,易溶于苯 |
(1)和普通分液漏斗相比,使用滴液漏斗的优点是_______________________;球形冷凝管进水口是____________(选填“a”或“b”)
(2)仪器X的名称是________________;装置中虚线部分的作用是____________。
(3)洗涤操作中,用2%Na2CO3溶液洗涤的目的是___________;水洗的目的是____________。
(4)在进行蒸馏操作时,应收集____________℃的馏分。
(5)该实验中,联苄的产率约为____________%(小数点后保留两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,如图是海水综合利用的一个方面。
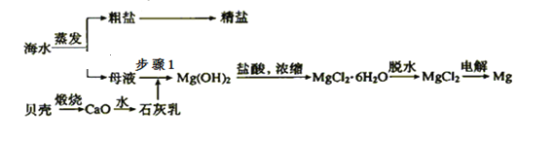
Ⅰ.(1)上述过程中没有涉及到的四大基本反应类型是______;
a.化合反应 b.分解反应 c.置换反应 d.复分解反应
(2)步骤1中分离操作的名称是___________;
(3)粗盐中含有Ca2+、Mg2+、SO42—等杂质,精制时所用试剂为:a.盐酸;b.BaCl2溶液;c.NaOH溶液;d.Na2CO3溶液。加入试剂的顺序是_________________________________;
II.实验室利用精盐配制480mL 2.0mol·L-1NaCl溶液。
(4)除容量瓶外,还需要的玻璃仪器有___________________;
(5)用托盘天平称取固体NaCl________g;
(6)配制时,按以下几个步骤进行:①计算 ②称量 ③溶解 ④冷却 ⑤转移 ⑥定容 ⑦摇匀
⑧装瓶。操作中还缺少一个重要步骤是______________________;
(7)下列错误操作可使所配制氯化钠溶液浓度偏低的是_________。
a.容量瓶洗净后残留了部分的水
b.转移时溶液溅到容量瓶外面
c.定容时俯视容量瓶的刻度线
d.摇匀后见液面下降,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg、Zn、Al混合物与足量稀H2SO4反应,生成H22.8L(标准状况),原混合物质量可能是( )
A. 2g B. 4g C. 10g D. 12g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以CO2和H2为原料制取乙醇的反应为 2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(g) ΔH<0。某压强下 的密闭容器中,按CO2和H2的物质的量比为 1∶3 投料,不同温度下,达到平衡后平衡体系中各物质的物质的量分数(y%)随温度变化如图所示。下列说法正确的是
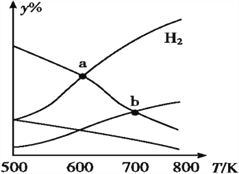
A. a点的平衡常数小于b点 B. b点:v正(CO2)=v逆(H2O)
C. a点:n(H2)=n(H2O) D. 温度不变,充入更多H2,v(CO2)始终不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g/100 mL)。
Ⅰ.实验步骤:
(1)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到100 mL容量瓶中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴____作指示剂。
(3)读取盛装0.100 0 mol/L NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________ mL。
![]()
(4)滴定。当___________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录:
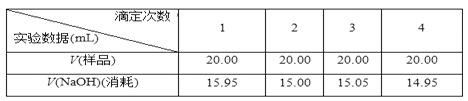
Ⅲ.实验处理:
(5)某同学在处理数据时计算得:平均消耗的NaOH溶液的体积V=(15.95+15.00+15.05+14.95)/4 mL=15.24 mL。 指出他的计算的不合理之处:_____;按正确数据处理,可得市售白醋总酸量=______ g/100 mL。(结果保留四位有效数字)
(6)在本实验的滴定过程中,下列操作会使实验结果偏大的是(填写序号)________。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗 b.碱式滴定管尖嘴滴定前有气泡,滴定后消失
c.锥形瓶中加入待测白醋溶液后,再加少量水 d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验室需要配制500mL0.10mol/LNa2CO3溶液。
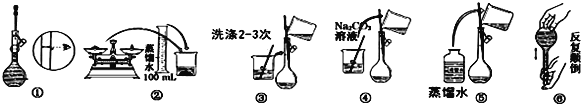
(1)所需玻璃仪器有:玻璃棒、烧杯、量筒、______、______。
(2)实验时图中所示操作的先后顺序为______(填编号)。
(3)在配制过程中,下列操作对所配溶液浓度如何?(填“偏高”、“偏低”或“无影响”)
①转移溶液后没有洗涤烧杯和玻璃棒______;
②向容量瓶加水定容时俯视液面______;
③摇匀后液面下降,再加水至刻度线______。
(4)所需Na2CO3固体的质量为__g;若改用浓溶液稀释,需要量取2mol/LNa2CO3溶液__mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com