
.下列事实不能用平衡移动原理解释的是
|
|
|
| |||||||||||||
| A | B | C | D |
【知识点】化学平衡移动原理 G2
【答案解析】B 解析:A、在氯化钠溶液中加入硝酸银溶液后生成氯化银沉淀,在氯化银沉淀中加入KI溶液后,氯化银沉淀转化为碘化银,是沉淀的相互转化,可以利用沉淀溶解平衡理论来解释;B、此反应I2(g)+H2(g) 2HI(g)不受压强的影响,故加压后颜色加深不能用平衡理论来解释;C、溶液中c(NH4Cl)的浓度变为原来的1/10,但是c (H+)没有变为原来的1/10,故在稀释过程中NH4+的水解平衡收到了影响,故可以用水解平衡理论来解释,错误;D、水的离子积会受到温度的影响是由于水的电离平衡受到了影响,错误。
2HI(g)不受压强的影响,故加压后颜色加深不能用平衡理论来解释;C、溶液中c(NH4Cl)的浓度变为原来的1/10,但是c (H+)没有变为原来的1/10,故在稀释过程中NH4+的水解平衡收到了影响,故可以用水解平衡理论来解释,错误;D、水的离子积会受到温度的影响是由于水的电离平衡受到了影响,错误。
【思路点拨】本题考查了化学平衡移动原理的应用,注意把握在体系中存在着的化学平衡是解答的关键,综合性较强。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.分子组成相差1个或若干个CH2原子团的物质互称为同系物
B.相对分子质量相同的有机物是同分异构体
C.碳原子之间只以单键相结合的链烃为烷烃
D.分子式相同的有机物一定是同一种物质
查看答案和解析>>
科目:高中化学 来源: 题型:
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为
________________________________________________________________________。
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表
示)________________________________________________________________________
________________________________________________________________________。
(3)C为0.1 mol·L-1的(NH4)2Fe(SO4)2溶液,与同浓度的(NH4)2SO4溶液中相比较______(填溶质的化学式)溶液中NH 的浓度更大,其原因是
的浓度更大,其原因是
________________________________________________________________________
________________________________________________________________________。
(4)D为含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:AgCl(s)
 Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
在25 ℃时,AgCl的Ksp=1.8×10-10mol2·L-2。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1 MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为______(填序号),此时溶液②中Cl-物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
.反应X(g)+Y(g)  2Z(g) ΔH<0,达到平衡时,下列说法正确的是
2Z(g) ΔH<0,达到平衡时,下列说法正确的是
A.减小容器体积,平衡向右移动 B.加入催化剂,Z的产率增大
C.增大c(X),X的转化率增大 D.降低温度,Y的转化率增大
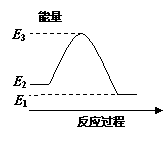
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在三个体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g) CH3OCH3(g)+H2O(g),则下列说法正确的是 ( )
CH3OCH3(g)+H2O(g),则下列说法正确的是 ( )
| 容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| I | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
A、该反应的正方向应为吸热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
.下列有关说法正确的是( )
A.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0
B.高温下,工业上用纯碱和石英砂制玻璃,说明硅酸的酸性强于碳酸
C.加热蒸干氯化铝溶液并灼烧残留物至质量不变,所得固体为氧化铝
D.高温下,用金属钠与氯化钾可以置换出金属钾,说明钠的金属性比钾强
查看答案和解析>>
科目:高中化学 来源: 题型:
水是最宝贵的资源之一。下列表述正确的是( )
A.H2O的电子式为H+[
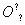
 H]-
H]-
B.4℃时,纯水的pH=7
C.D O中,质量数之和是质子数之和的两倍
O中,质量数之和是质子数之和的两倍
D.273 K、101 kPa,水分子间的平均距离d:d(气态)>d(液态)>d(固态)
查看答案和解析>>
科目:高中化学 来源: 题型:
将蔗糖溶于水配成10%的溶液,分装在两个试管中。在第一个试管中加入几滴稀硫酸并水浴加热,然后再加入新制的Cu(OH)2悬浊液并加热,没有砖红色沉淀产生,原因是______________________________;在第二个试管中加入几滴稀硫酸,再放在水浴中加热,再加入足量的NaOH溶液并加入新制的Cu(OH)2悬浊液,加热后的现象是________________,加入足量NaOH溶液的作用是______________________________。上述实验中发生反应的化学方程式是___________________________________
_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
2 000 K时,反应CO(g)+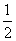 O2(g)
O2(g)
 CO2(g)的平衡常数为K,则相同温度下反应2CO2(g)
CO2(g)的平衡常数为K,则相同温度下反应2CO2(g)
 2CO(g)+O2(g)的平衡常数K′为( )
2CO(g)+O2(g)的平衡常数K′为( )
A. B.K2 C.
B.K2 C.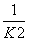 D.
D.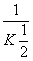
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com