
【题目】硼(B)可形成H3BO3、NaBH4、NaBO2等化合物,用途广泛。
(1)H3BO3为一元弱酸,常温下,在水中存在如下电离平衡:
H3BO3 + H2O![]() [B(OH)4]-+H+,Ka=5.72×10-10。
[B(OH)4]-+H+,Ka=5.72×10-10。
① 25℃时,0.175 mol/L的H3BO3溶液pH约为_________(取整数)。
② 已知碳酸H2CO3的电离平衡常数为Ka1 = 4.4×10-7,Ka2 = 5.6×10-11。将少量碳酸钠溶液滴加到饱和硼酸溶液中,反应的离子方程式为_________。
(2)在容积恒定为2 L的密闭容器中加入足量BPO4和Na固体并充入一定量的H2(g)发生储氢反应:BPO4(s)+4Na(s)+2H2(g)![]() Na3PO4(s)+NaBH4(s) △H<0
Na3PO4(s)+NaBH4(s) △H<0
① 体系中H2的物质的量与反应时间的关系如表所示:
t /min | 0 | 2 | 4 | 6 | 8 | 10 |
n(H2)/mol | 2.0 | 1.5 | 1.2 | 0.9 | 0.8 | 0.8 |
下列有关叙述正确的是(填标号)_________。
a. 当容器内气体的摩尔质量不再变化时,反应达到平衡状态
b. 10 min时向容器内通入少量H2,则重新达平衡前ν(放氢)> ν(吸氢)
c. 保持温度不变,平衡后再充入1 mol H2,达新平衡时H2的浓度为0.4 mol/L
d. 升高温度,放氢速率加快,重新达到平衡时容器压强增大
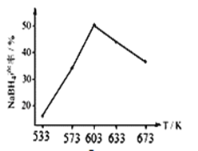
② 下图为相同时间,NaBH4的产率与反应温度的关系曲线。NaBH4的产率在603K之前随温度升高而增大的原因是_________。
(3)NaBH4(s)遇H2O(l)剧烈水解,生成氢气和NaBO2(s)。
① 通常状况下,实验测得3.8gNaBH4(s)发生水解反应放出21.6 kJ热量,写出该反应的热化学方程式_________。
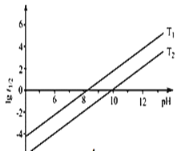
② t1/2为NaBH4水解的半衰期(水解一半所需要的时间,单位为min)。lg t1/2随pH和温度的变化如图所示。溶液pH=4时,NaBH4________(填“能”或“不能”)稳定存在;T1_________T2。(填 “>”或“<”)
【答案】5 CO32-+H2O+H3BO3=HCO3-+[B(OH)4]- cd 603K之前,反应未达到平衡状态,温度升高,反应速率加快 NaBH4(s)+2H2O(l)=NaBO2(s)+4H2(g) △H= -216kJ/mol 不能 <
【解析】
(1)根据K= 计算;②根据硼酸和碳酸的电离常数可知,酸性碳酸>硼酸>碳酸氢根离子,书写将少量碳酸钠溶液滴加到饱和硼酸溶液中反应的离子方程式;
计算;②根据硼酸和碳酸的电离常数可知,酸性碳酸>硼酸>碳酸氢根离子,书写将少量碳酸钠溶液滴加到饱和硼酸溶液中反应的离子方程式;
(2)①该反应前后只有氢气为气体,平衡常数K=![]() ,据此分析判断;②建立平衡状态的过程中,温度升高,反应速率加快;
,据此分析判断;②建立平衡状态的过程中,温度升高,反应速率加快;
(3)①3.8gNaBH4(s)的物质的量=![]() =0.1mol,则1mol NaBH4(s)放出216kJ热量,据此书写反应的热化学方程式;②NaBH4可水解放出氢气,在酸性条件下,NaBH4和酸反应生成硼酸和氢气,结合影响盐类水解的因素分析解答。
=0.1mol,则1mol NaBH4(s)放出216kJ热量,据此书写反应的热化学方程式;②NaBH4可水解放出氢气,在酸性条件下,NaBH4和酸反应生成硼酸和氢气,结合影响盐类水解的因素分析解答。
(1)25℃时,0.175mol/L硼酸溶液中K= ,而c([B(OH)4]-)=c(H+),故c(H+)=
,而c([B(OH)4]-)=c(H+),故c(H+)=![]() =
=![]() =10-5mol/L,则pH=5,故答案为:5;
=10-5mol/L,则pH=5,故答案为:5;
②根据硼酸和碳酸的电离常数可知,酸性碳酸>硼酸>碳酸氢根离子,因此将少量碳酸钠溶液滴加到饱和硼酸溶液中,反应的离子方程式为CO32-+H2O+H3BO3=HCO3-+[B(OH)4]-,故答案为:CO32-+H2O+H3BO3=HCO3-+[B(OH)4]-;
(2)①a. 该反应前后只有氢气为气体,气体的摩尔质量始终不变,容器内气体的摩尔质量不再变化时,不能判断反应达到平衡状态,故a错误;b. 根据表格数据,10 min时处于平衡状态,此时向容器内通入少量H2,相当于增大压强,氢气的浓度,正反应速率大于逆反应速率,即ν(放氢)<ν(吸氢),故b错误;c. 温度不变,平衡常数K=![]() 不变,保持温度不变,平衡后再充入1 mol H2,新平衡与原平衡等效,氢气的浓度相同,为
不变,保持温度不变,平衡后再充入1 mol H2,新平衡与原平衡等效,氢气的浓度相同,为![]() =0.4 mol/L,故c正确;d. 升高温度,正逆反应速率均加快,平衡逆向移动,氢气增多,压强增大,故d正确;故选cd;
=0.4 mol/L,故c正确;d. 升高温度,正逆反应速率均加快,平衡逆向移动,氢气增多,压强增大,故d正确;故选cd;
②NaBH4的产率在603K之前,因为反应未达到平衡状态,温度升高,反应速率加快,NaBH4的产率随温度升高而增大,故答案为:603K之前,反应未达到平衡状态,温度升高,反应速率加快;
(3)①NaBH4可水解放出氢气,反应方程式为:NaBH4+2H2O═NaBO2+4H2↑,3.8gNaBH4(s)的物质的量=![]() =0.1mol,则1mol NaBH4(s)放出216kJ热量,反应的热化学方程式为NaBH4(s)+2H2O(l)=NaBO2(s)+4H2(g) △H= -216kJ/mol,故答案为:NaBH4(s)+2H2O(l)=NaBO2(s)+4H2(g) △H= -216kJ/mol;
=0.1mol,则1mol NaBH4(s)放出216kJ热量,反应的热化学方程式为NaBH4(s)+2H2O(l)=NaBO2(s)+4H2(g) △H= -216kJ/mol,故答案为:NaBH4(s)+2H2O(l)=NaBO2(s)+4H2(g) △H= -216kJ/mol;
②NaBH4可水解放出氢气,反应方程式为:NaBH4+2H2O═NaBO2+4H2↑,因此NaBH4在酸性条件下,NaBH4和酸反应生成硼酸和氢气,反应的离子方程式为:BH4-+H++3H2O=H3BO3+4H2↑,不能稳定性存在;水解反应为吸热反应,升温促进水解,半衰期缩短,故T1<T2,故答案为:不能;<。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学利用如图所示实验装置进行某些气体的制备、性质等实验(图中夹持装置有省略)。请按要求填空:


Ⅰ.探究氯气与氨气的反应
(1)为制取干燥氨气,可将装置C与___(填装置名称)连接;装置C中的烧瓶内固体宜选用___。
a.氯化钙 b.碱石灰 c.五氧化二磷 d.生石灰
(2)装置A、E、E连接可制取纯净、干燥的氯气,则两个E装置内的药品依次是__。
(3)装置F可用于探究氯气与氨气的反应。实验时打开开关1、3,关闭2,先向烧瓶中通入___(填名称),然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体。实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体中的阳离子___,F的烧杯中所装液体为__,所起的作用是__。
Ⅱ.探究某些物质的性质
(1)利用装置A、E,可设计实验比较Cl-和Br-的还原性强弱。将装置A中产生的气体通入盛有NaBr溶液的装置E中,充分反应后取下E,加入CCl4,静置后观察到____的实验现象,则证明Br-的还原性强于Cl-。
(2)将装置B、C分别与F相连后,进行H2S与SO2反应的实验。简述检查装置B气密性的操作____,F的烧瓶中发生反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,在干燥的烧瓶中充满纯净的NH3,进行如图所示的喷泉实验,下列说法错误的是
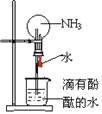
A.本实验之所以能够产生喷泉是因为氨气极易溶于水,导致烧瓶内外存在压强差
B.若烧瓶的氨气中混有少量空气,则喷泉实验后的水不能充满烧瓶
C.本实验若将NH3换成HCl,也能产生红色的喷泉
D.实验结束后,烧瓶中氨水的物质的量浓度为![]() mol/L。
mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硝酸铵在不同温度下分解会有不同的产物,反应方程式如下,
①NH4NO3![]() NH3↑+HNO3↑②NH4NO3
NH3↑+HNO3↑②NH4NO3![]() N2O↑+2H2O↑
N2O↑+2H2O↑
③2NH4NO3![]() 2N2↑+O2↑+4X↑④4NH4NO3
2N2↑+O2↑+4X↑④4NH4NO3![]() 3N2↑+2NO2↑+8H2O↑
3N2↑+2NO2↑+8H2O↑
请回答下列问题:
(1)这四个反应中属于氧化还原反应的有___个。
(2)反应③中物质X的化学式是___。
(3)反应④中氧化产物和还原产物依次是___、___。(填化学式)
(4)若反应③生成标准状况下的11.2L氧气,则转移电子数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一瓶溶液只含K+、Mg2+、Fe3+、Cl-、CO32-、SO42-六种离子中的某几种.通过实验:
①原溶液![]() 白色沉淀;②原溶液中加BaCl2溶液不产生沉淀;
白色沉淀;②原溶液中加BaCl2溶液不产生沉淀;
③原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解,回答下列问题:
(1)试分析原溶液中一定含有的离子是___,一定不含有的离子是___,可能含有的离子是__。
(2)有的同学认为实验③可以省略,你认为是否正确(填“是”或“否”)___,理由是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)烷烃C5H12的一种同分异构体只能生成一种一氯代物,该异构体的结构简式为______。
(2)2,2,3,3-四甲基戊烷的结构简式为:___________。
(3)![]() 的系统命名:________。
的系统命名:________。
(4)1mol不饱和烃可以和1molCl2发生加成反应,生成2-甲基-2,3-二氯戊烷,则该不饱和烃的结构简式是:______。
(5)相对分子量相近的醇和烷烃相比,醇的沸点远远高于烷烃,原因是__________。
(6)相同质量的甲烷,乙烷,乙烯和乙炔,完全燃烧后生成CO2最多的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下,0.1 mol·L1 H2C2O4的pH=1.3)
实验 | 装置 | 试剂a | 现象 |
① |
| Ca(OH)2溶液(含酚酞) | 溶液褪色,产生白色沉淀 |
② | 少量NaHCO3溶液 | 产生气泡 | |
③ | 酸性KMnO4溶液 | 紫色溶液褪色 | |
④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式不正确的是
A. H2C2O4有酸性,Ca(OH)2+ H2C2O4![]() CaC2O4↓+2H2O
CaC2O4↓+2H2O
B. 酸性:H2C2O4> H2CO3,NaHCO3+ H2C2O4![]() NaHC2O4+CO2↑+H2O
NaHC2O4+CO2↑+H2O
C. H2C2O4具有还原性,2![]() +5
+5![]() +16H+
+16H+![]() 2Mn2++10CO2↑+ 8H2O
2Mn2++10CO2↑+ 8H2O
D. H2C2O4可发生酯化反应,HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的工业原料。
(1)工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为____。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为____。
下列反应中的氨与氨氧化法中的氨作用相同的是___。
A.2Na+2NH3=2NaNH2+H2↑ B.2NH3+3CuO=3Cu+N2+3H2O
C.4NH3+6NO=5N2+6H2O D.HNO3+NH3=NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH﹣=NO2-+NO3-+H2O和NO+NO2+2OH﹣=___+H2O(配平该方程式)。
(3)向27.2gCu和Cu2O的混合物中加入某浓度的稀HNO3500mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1L1mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2g。
①Cu与稀HNO3反应的离子方程式为________。
②Cu与Cu2O 的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸的消费量是衡量一个国家化工生产水平的重要标志。而在硫酸的生产中,最关键的一步反应为:2SO2(g)+O2(g)![]() 2SO3(g)。
2SO3(g)。
(1)一定条件下,SO2与O2反应10min后,若SO2和SO3物质的量浓度分别为1mol/L和3mol/L,则SO2起始物质的量浓度为___________________;10min生成SO3的化学反应速率为___________________。
(2)下列关于该反应的说法正确的是___________________。
A.增加O2的浓度能加快反应速率
B.降低体系温度能加快反应速率
C.使用催化剂能加快反应速率
D.一定条件下达到反应限度时SO2全部转化为SO3
(3)工业制硫酸,用过量的氨水对SO2尾气处理,请写出相关的离子方程式:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com