
���ֶ�����Ԫ��A��B��C��D��E��ԭ��������������A��Cͬ�壬B��D ͬ�壬C���Ӻ�B���Ӿ�����ͬ�ĵ��Ӳ�ṹ��A��B��D��E�����γɹ����ͻ����A��B�γɵĻ�������ˮ�гʼ��ԣ�C��E�γɵĻ�������ˮ�г����ԡ�����˵����ȷ����
A������Ԫ����ԭ�Ӱ뾶������E����С����A
B��A��B��D��E�����γɹ����ͻ������У��ȶ���������A��D�γɵĻ�����
C��E����������Ӧˮ���ﻯѧʽΪH2EO4
D��C�ĵ����ڿ�����ȼ�ղ���Ļ�ѧʽΪC2O
 ���㼤�������100�ִ��Ծ�ϵ�д�
���㼤�������100�ִ��Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����������������ϡHNO3�пɷ������·�Ӧ��
3Fe3O4+28HNO3===9Fe(NO3)x + NO�� + 14H2O�������жϺ�������
A��Fe(NO3)x�е�xΪ2
B����Ӧ��ÿ��ԭ0.2 mol������������0.6 mol����ת��
C��ϡHNO3�ڷ�Ӧ��ֻ����������
D�������������е�������Ԫ��ȫ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ӿ���ѧ���ϲ�ã�һ����������Ȼ��������·�Ӧ��14CuSO4��5FeS2��12H2O====7Cu2S��5FeSO4��12H2SO4������˵����ȷ����(����)
A.Cu2S���������������ǻ�ԭ����
B.5 mol FeS2������Ӧ����10 mol����ת��
C.�����е�SO ��һ��������������
��һ��������������
D.FeS2ֻ����ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��1����ҵ��һ������������ַ�Ӧ�ϳɼ״���
��Ӧ�� CO(g) �� 2H2(g)  CH3OH(g) ��H1
CH3OH(g) ��H1
��Ӧ�� CO2(g) �� 3H2(g)  CH3OH(g) + H2O(g) ��H2
CH3OH(g) + H2O(g) ��H2
���±����������Ƿ�Ӧ���ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
�ɱ��������жϦ�H1 0 �����������������������
��ij�¶��£���2 mol CO��6 mol H2����2L���ܱ������У���ַ�Ӧ���ﵽƽ����c(CO)�� 0.2 mol��L����CO��ת����Ϊ ����ʱ���¶�Ϊ �����ϱ���ѡ��
��2����֪�ڳ��³�ѹ�£�
�� 2CH3OH(l) �� 3O2(g) �� 2CO2(g) �� 4H2O(l) ��H1����1451.6kJ��mol
�� 2CO (g)+ O2(g) �� 2CO2(g) ��H2 ����566.0kJ��mol
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��
��3��ijʵ��С�����ݼ״�ȼ�յķ�Ӧԭ������� ����ͼ��ʾ�ĵ��װ�ã�

�ٸõ�ص�����ת����ʽΪ ��
�ڸõ�������ĵ缫��ӦΪ ��
�۹���һ��ʱ������Һ��pH��С����õ���ܷ�Ӧ�Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����й�ʵ��װ�ý��е���Ӧʵ�飬�ܴﵽʵ��Ŀ�ĵ���
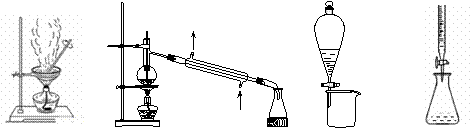

ͼ1 ͼ2 ͼ3 ͼ4
A������ͼ1װ�ÿɴ��Ȼ�����Һ��ֱ�������ᾧ����Ȼ�������
B������ͼ2װ�ÿɷ���ʯ�ͣ��õ����͡�ú�ͺͲ��͵ȸ������
C������ͼ3װ�ÿɷ���CH3CH2OH��CH3COOC2H5���Һ
D������ͼ4װ�ÿɽ�������к͵ζ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����IJ����Ǻ���һ�����һ���ˮƽ�ı�־��2SO2(g) + O2(g)  2SO3(g)�ǹ�ҵ���������Ҫ��Ӧ֮һ��һ���¶��£��ڼס��ҡ��������ݻ���Ϊ2 L�ĺ����ܱ�������Ͷ��SO2(g)��O2(g)������ʼ���ʵ�����SO2��ƽ��ת�������±���ʾ��
2SO3(g)�ǹ�ҵ���������Ҫ��Ӧ֮һ��һ���¶��£��ڼס��ҡ��������ݻ���Ϊ2 L�ĺ����ܱ�������Ͷ��SO2(g)��O2(g)������ʼ���ʵ�����SO2��ƽ��ת�������±���ʾ��
| �� | �� | �� | ||
| ��ʼ���ʵ��� | n(SO2) / mol | 0.4 | 0.8 | 0.8 |
| n(O2) / mol | 0.24 | 0.24 | 0.48 | |
| SO2��ƽ��ת���� | 80% | ��1 | ��2 |
�����ж��У���ȷ����
A�����з�Ӧ��ƽ�ⳣ��С���� B��ƽ��ʱ������c(SO3)�Ǽ��е�2��
C�����¶��£�ƽ�ⳣ��ֵΪ400 D��ƽ��ʱ��SO2��ת���ʣ���1<80%<��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������Ⱦ����Խ��Խ�ܵ����ǵĹ�ע����ɻ�����Ⱦ����Ҫԭ��������������������й����ŷ��й���������ġ����л�������������Ӧ�����ʲ���ص���
A������ЧӦ——������̼
B���⻯ѧ��Ⱦ——��������
C������——������̼
D���������ƻ�——������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪�������������Ũ���ᷴӦ�ܷų��������ְ�����ͼ��������������ʵ�顣�������ڷֱ�װ�е���������ͬ��Һ�İ�ɫ����Ӧ—��ʱ���ͼ��ָ����λ��ɫ������ȷ����

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com