【答案】
分析:(1)根据m=CVM计算溶质的质量,注意V应该是500mL,强腐蚀性的固体药品应放在烧杯中称量;
(2)根据仪器的作用选取仪器;
(3)配制溶液的步骤是:称量、溶解、冷却、转移、洗涤、转移、定容、摇匀,据此排序;
(4)定容的做法是:用胶头滴管逐滴加水,当溶液凹液面最低处与刻度线相切时,立即停止加水;
(5)根据C=
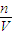
判断配制溶液的误差,如果n偏小或C偏大,则配制溶液的浓度偏低,如果n偏大或V偏小,则配制溶液的浓度偏高;
(6)溶液的物质的量浓度与溶液的体积无关,根据m=CVM、n=CV计算氢氧化钠的质量和物质的量;
(7)根据溶液稀释前后溶质的物质的量不变计算.
解答:解:(1)m=CVM=0.1mol/L×0.5L×40g/mol=2.0g,烧碱易吸水且具有强腐蚀性,所以称量烧碱时要放在烧杯中,故答案为:2.0g,烧杯;
(2)溶液配制过程中,用烧杯溶解烧碱,用玻璃棒搅拌和引流,用500mL的容量瓶配制溶液,用胶头滴管定容,用托盘天平称量烧碱,用药匙取药品,故选A、C、D、F、H、I;
(3)配制溶液的步骤是:称量、溶解、冷却、转移、洗涤、转移、定容、摇匀,所以其排序是⑤①④⑥③⑥⑦②,
故答案为:⑤①④⑥③⑥⑦②;
(4)完成后期加入少量水即定容的做法是:用胶头滴管逐滴加水,当溶液凹液面最低处与刻度线相切时,立即停止加水,故答案为:用胶头滴管逐滴加水,当溶液凹液面最低处与刻度线相切时,立即停止加水;
(5)A.在天平托盘上垫纸,将NaOH放在纸上称量,氢氧化钠易潮解导致溶质的物质的量偏小,则配制溶液的浓度偏低;
B.NaOH溶解时放出大量的热,未冷却立即配制溶液,导致溶液的体积偏小,则配制溶液的浓度偏高;
C.溶解NaOH固体之后的烧杯未洗涤,导致溶质的物质的量偏小,则配制溶液的浓度偏低;
D.向容量瓶中转移溶液时不慎洒出,导致溶质的物质的量偏小,则配制溶液的浓度偏低;
故选B;
(6)溶液的物质的量浓度与溶液的体积无关,所以其浓度仍是0.1 mol?L
-1,m=CVM=0.1mol/L×0.01L×40g/mol=0.04g,n=CV=0.1mol/L×0.01L=0.001mol,故答案为:0.1 mol?L
-1,0.04g,0.001mol;
(7)溶液稀释前后溶质的物质的量不变,溶液的体积变为原来的10倍,则溶液的物质的量浓度变为原来的
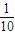
,为0.01 mol?L
-1,故答案为0.01mol/L.
点评:本题考查了一定物质的量浓度溶液的配制,难度不大,注意计算胆矾的质量时,V应该是500mL而不是490mL,为易错点.

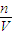 判断配制溶液的误差,如果n偏小或C偏大,则配制溶液的浓度偏低,如果n偏大或V偏小,则配制溶液的浓度偏高;
判断配制溶液的误差,如果n偏小或C偏大,则配制溶液的浓度偏低,如果n偏大或V偏小,则配制溶液的浓度偏高;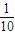 ,为0.01 mol?L-1,故答案为0.01mol/L.
,为0.01 mol?L-1,故答案为0.01mol/L.
