
| A. | 原子半径C>D>E,三者形成的简单离子中D离子的半径最小 | |
| B. | 元素A所形成的氢化物常温下一定为气态 | |
| C. | 元素C、D、E在自然界中均不能以游离态存在 | |
| D. | 元素B的氧化物对应的水化物一定为强酸 |
分析 E原子最外层电子数是B原子内层电子数的3倍或者C原子最外层电子数的3倍,说明E元素最外层电子数为6,则C最外层电子数为2,B、C、E原子的最外层电子数之和为13,说明B元素最外层电子数为13-6-2=5,则B元素的核外电子数为2+5=7,为N元素,E的原子序数最大,应为S元素,则C应为Mg元素,B、D原子最外层电子数之和等于C、E原子最外层电子数之和,即2+6=8,则D的最外层电子数为8-5=3,应为Al元素,A、B两元素相邻,则A应为C元素,结合元素对应单质化合物的性质以及元素周期律解答该题.
解答 解:E原子最外层电子数是B原子内层电子数的3倍或者C原子最外层电子数的3倍,说明E元素最外层电子数为6,则C最外层电子数为2,B、C、E原子的最外层电子数之和为13,说明B元素最外层电子数为13-6-2=5,则B元素的核外电子数为2+5=7,为N元素,E的原子序数最大,应为S元素,则C应为Mg元素,B、D原子最外层电子数之和等于C、E原子最外层电子数之和,即2+6=8,则D的最外层电子数为8-5=3,应为Al元素,A、B两元素相邻,则A应为C元素,则A为C元素,B为N元素,C为Mg元素,D为Al元素,E为S元素,
A.C应为Mg元素,D为Al元素,E为S元素,同周期从左到右半径逐渐减小,所以原子半径C>D>E;离子中硫离子的电子层数最多,镁离子和铝离子的电子层数相同,核电荷越大半径越小,所以铝离子的半径最小,故A正确;
B.元素C所形成的氢化物中,如C原子数大于4个,则为液态或固态,故B错误;
C.S可存在于火山喷口附近,故C错误;
D.如为HNO2,则为弱酸,故D错误.
故选A.
点评 本题考查原子的结构与元素的性质,为高考常见题型,题目难度中等,解答本题时,正确推断元素的种类为解答该题的关键,注意元素周期律的把握.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | ①变轻,②变重,③不变 | B. | ①变轻,②不变,③变重 | ||
| C. | ①变轻,②不变,③不变 | D. | ①变重,②不变,③变轻 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ②KCl
②KCl (3)H2O2
(3)H2O2 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①③④⑤ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.
燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
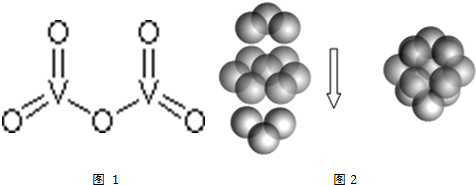
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
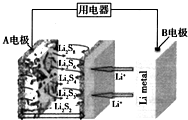
| A. | B电极为正极 | |
| B. | A电极上的电极反应式为:2Li++S8+2e-═Li2S8 | |
| C. | 每生成1molLi2S8转移0.25 mol电子 | |
| D. | 给该电池充电时,A电极连接电源的负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
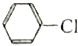 的水解反应均有醇生成.
的水解反应均有醇生成.| A. | 全都正确 | B. | 除⑤ | C. | 除⑥ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com