
分析 (1)质子数=原子序数,质子数+中子数=质量数,根据原子表示法来回答;
(2)根据原子中质子数等于核电荷数等于核外电子数,以及元素的原子核外电子排布规律结合选项中的原子情况回答即可;
(3)①质子数和中子数只要其一不相同就属于不同核素;元素的种类由质子数决定,质子数不同,元素的种类就不同;
②质子数相同,而中子数不同的原子,互称为同位素;
③原子符号左上角的数字为质量数;中子数=质量数-质子数.
解答 解:(1)质子数=原子序数,质子数决定元素种类,所以含有8个质子的元素是O,并且质子数+中子数=质量数,所以该元素的质量数是18,表示为818O,
故答案为:818O;
(2)核电荷数为4的原子为锂,核外电子排布第一层2个电子,第二层1个电子,符合某原子最外层电子数是次外层电子数的$\frac{1}{2}$的要求,核电荷数为14的原子为硅原子,核外电子的排布情况是第一层2个,第二层是8个(次外层),第三层4个(最外层),符合某原子最外层电子数是次外层电子数的$\frac{1}{2}$的要求,
故答案为:Li Si;
(3)①11H、21H、31H、都属于氢元素,14C属于碳元素14N属于氮元素,16O属于氧元素,35Cl2、37Cl2都属于氯元素,一共有6种核素,5种元素,
故答案为:6;5;
②11H、21H、31H、都属于氢元素,质子数相同,而中子数不同互为同位素,
故答案为:11H、21H、31H;
③原子符号左上角的数字为质量数,则质量数相等的是14C和14N,14C中中子数=14-6=8,16O 的中子数=16-8=8,所以二者中子数相同,
故答案为:14C;14N; 14C、16O.
点评 本题主要考查了核数的种类、元素的种类、同位素的概念、核外电子数的计算、试题培养了学生的分析能力及概念实质的理解能力,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
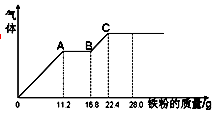 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶19.2g(己知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.回答下列问题:
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶19.2g(己知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
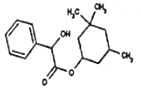
| A. | 环扁桃酸酯的分子式为C17H24O3 | |
| B. | 环扁桃酸酯在水中几乎不溶,在乙醇或丙酮中易溶解 | |
| C. | 环扁桃酸酯可以发生加成、取代、消去等反应 | |
| D. | 1 mol环扁桃酸酯最多可以与1 mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验现象或事实 | 解释 |
| A | 检验待测溶液中SO42-,先滴入稀盐酸,再滴入BaCl2溶液 | 先滴入盐酸可排除Ag+、CO3-、SO32-等离子干扰 |
| B | 铝箔插入稀硝酸中 | 铝箔表面被HNO3氧化形成致密的氧化膜 |
| C | 向Fe(NO3)2溶液中加入稀硫酸,试管口有红棕色气体产生 | 溶液中NO3-被Fe2+还原为NO2 |
| D | 含Mg(HCO3)2的硬水长时间充分加热,最终得到的沉淀物的主要成分为Mg(OH)2而不是MgCO3 | Kap(MgCO3)<Kap[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应可在瞬间产生大量高温气体,推动火箭飞行且反应产物对环境无污染 | |
| B. | 向火箭注入燃料的操作非常严格,不能有丝毫失误,因为该反应的缺点是反应物有毒、有污染 | |
| C. | 偏二甲肼的燃烧热为△H=-2550 kJ/mol | |
| D. | 该反应中1mol C2H8N2反应时转移16 mol e- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
| A. | Na2SO3溶液中c(H+)<c (OH-) | |
| B. | Na2SO3溶液中c(Na+))>c (SO32-)>c (HSO3-)>c (OH-)>c(H+) | |
| C. | 当吸收液呈中性时,c(Na+))>c (SO32-)>c (HSO3-)>c (OH-)=c(H+) | |
| D. | 当吸收液呈中性时,c(Na+)>c (HSO3-)+c (SO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2C(s)+2O2(g)═2CO2(g)△H=a kJ•mol-1;2C(s)+O2(g)═2CO(g)△H=b kJ•mol-1,则a>b | |
| B. | 由H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1可知,若将含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3 kJ | |
| C. | 由C(石墨)═C(金刚石)△H=+1.9 kJ•mol-1可知,金刚石比石墨稳定 | |
| D. | 在100 kPa时,1 g H2完全燃烧生成液态水,放出285.8 kJ热量,则H2燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 盐 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | -- | -- | -- | -- |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.l | 12.7 | 14.5 | 16.4 | -- |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com