

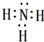 .
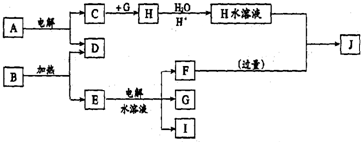
.分析 A、B、C、D都是短周期非金属单质,其中B、C、D在常温常压下是气体,化合物E是形成酸雨的污染物之一,则E为SO2;由反应①可推知A为S,B为O2;化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得,则L为NaClO;F是常见的四原子10电子分子,F应为NH3;氨气与NaClO反应生成J,J由两种元素组成的18电子分子,分子中原子个数比为1:2,其相对分子质量为32,常温下为液体,则J为N2H4;J与氧气反应生成C,C为氮气,由反应②可知D为H2,据此进行解答.
解答 解:A、B、C、D都是短周期非金属单质,其中B、C、D在常温常压下是气体,化合物E是形成酸雨的污染物之一,则E为SO2;由反应①可推知A为S,B为O2;化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得,则L为NaClO;F是常见的四原子10电子分子,F应为NH3;氨气与NaClO反应生成J,J由两种元素组成的18电子分子,分子中原子个数比为1:2,其相对分子质量为32,常温下为液体,则J为N2H4;J与氧气反应生成C,C为氮气,由反应②可知D为H2,
(1)由上述分析可知,F为氨气,氨气为共价化合物,其电子式为: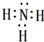 ,
,
故答案为: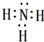 ,
,
(2)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的化学方程式为:Cl2+2NaOH═NaCl+NaClO+H2O,
故答案为:Cl2+2NaOH═NaCl+NaClO+H2O;
(3)N2H4在O2中完全燃烧生成N2,同时应生成水,16g N2H4的物质的量=$\frac{16g}{32g/mol}$=0.5mol,完全燃烧恢复至101kPa、25℃,放出312kJ热量,则1mol N2H4完全燃烧方程式的热量为624kJ,所以该反应的热化学方程式为:N2H4(l)+O2(g)═N2(g)+2H2O(l)△H=-624 kJ/mol,
故答案为:N2H4(l)+O2(g)═N2(g)+2H2O(l)△H=-624 kJ/mol;
(4)将SO2通入NaClO的碱性溶液,ClO-将SO2氧化为SO42-,自身被还原为Cl-,反应的离子方程式为:ClO-+SO2+2OH-═Cl-+SO42-+H2O,
故答案为:ClO-+SO2+2OH-═Cl-+SO42-+H2O;
(5)N2H4-空气燃料电池是一种环境友好的碱性燃料电池,电解质溶液是20%~30% KOH溶液,总反应为生成氮气与水,故负极为N2H4失去电子,碱性条件下生成氮气与水,该燃料电池的负极反应式为:N2H4+4OH--4e-═4H2O+N2↑,
故答案为:N2H4+4OH--4e-═4H2O+N2↑;
(6)标况下1.12L二氧化硫的物质的量为:$\frac{1.12L}{22.4L/mol}$=0.05mol,n(NaOH)=0.1L×0.5mol/L=0.05mol,n(SO2):n(NaOH)=0.05mol:0.05mol=1:1,故反应后溶液中溶质为NaHSO3,溶液呈酸性,说明HSO3-的电离程度大于水解程度,同时水电离生成氢离子,故c(H+)>c(SO32-),HSO3-电离程度不大,故c(HSO3-)>c(H+),溶液c(OH-)等于水电离生成,浓度很小,故溶液中离子浓度由大到小的排列顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
故答案为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-).
点评 本题以无机框图的形式首先考查了元素的推断,并根据推出的物质考查了电化学、化学反应速率及热化学方程式的相关知识,为高频考点,题目难度中等,把握物质的性质及转化关系图来推断出各物质是解答本题的关键.


科目:高中化学 来源: 题型:选择题
 “盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O=2Mg(OH)2.下列关于该电池的说法错误的是( )
“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O=2Mg(OH)2.下列关于该电池的说法错误的是( )| A. | 镁片作为正极 | |
| B. | 食盐水作为电解质溶液 | |
| C. | 电池工作时镁片逐渐被消耗 | |
| D. | 电池工作时实现了化学能向电能的转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 采用加热分解法冶炼金属钾 | B. | 采用电解法冶炼金属铝和钠 | ||
| C. | 采用热还原法冶炼金属铁与汞 | D. | 采用热还原法冶炼金属铜与钙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78 gNa2O2晶体中所含阴阳离子个数均为2NA | |
| B. | 1.5 g CH3+中含有的电子数为NA | |
| C. | 3.4 g氨气分子中含有0.6NA个N-H键 | |
| D. | 常温下,100 mL1 mol•L-1AlCl3溶液中Al3+离子总数等于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
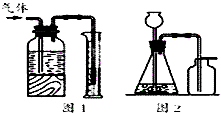
| A. | 用图1所示装置可测量产生气体的体积 | |
| B. | 用0.1000mol/L标准盐酸滴定未知浓度的氨水,用甲基橙作指示剂 | |
| C. | 用二氧化锰和浓盐酸制备少量氯气可在图2所示装置中进行 | |
| D. | 鉴别pH=8.3的NaOH溶液和pH=8.4的苯酚钠溶液,可选用广泛pH试纸检测 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | A | B | C | D |
实验 装置 |  | 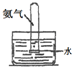 | 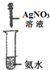 | 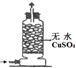 |
| 实验 目的 | 实验室模拟侯氏制碱法制备NH4HCO3 | 验证NH3易溶于水 | 制备银氨溶液 | 干燥NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
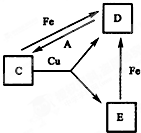 有A、B、C、D、E、F六种常见物质,将它们分别溶于水,所得溶液颜色各不相同.已知:
有A、B、C、D、E、F六种常见物质,将它们分别溶于水,所得溶液颜色各不相同.已知:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com