
分析 (1)草酸是二元弱酸,分步电离;
(2)相同条件下,酸的电离平衡常数越大,其电离程度越大,则酸根离子的水解程度越大,溶液的碱性越强;
(3)常温下,0.4mol/L的KOH溶液20mL与0.2mol/L的草酸溶液20mL恰好反应生成草酸钠,草酸根离子易水解而使其溶液呈碱性,但第一步水解大于第二步;
(4)酸性高锰酸钾具有强氧化性,能氧化强还原性的物质;
酸性高锰酸钾和草酸发生氧化还原反应生成锰离子、二氧化碳和水;
(5)草酸钙在水溶液里存在电离平衡,加水促进平衡向溶解的方向移动;
(6)根据电离平衡常数可知:H2C2O4>H2CO3>HCO3-,故往Na2CO3溶液中加入少量草酸溶液,能反应生成HCO3-和C2O42-;
(7)依据碳酸钙溶度积常数计算钙离子浓度,等体积混合后钙离子和草酸根离子浓度减少一半,根据草酸钙的溶度积常数计算得到醋酸根离子的最小浓度.
解答 解:(1)草酸是二元弱酸,在水溶液里存在两步电离,第一步电离程度大于第二步,其电离方程式分别为:H2C2O4?HC2O4-+H+、HC2O4-?C2O42-+H+,故答案为:H2C2O4?HC2O4-+H+、HC2O4-?C2O42-+H+;
(2)草酸的第二步电离平衡常数大于碳酸的第二步电离平衡常数,电离平衡常数越小,其酸根离子的水解程度越大,所以碳酸根离子的水解程度大于草酸根离子,导致草酸钠的pH小于碳酸钠,
故答案为:小;
(3)常温下,0.4mol/L的KOH溶液20mL与0.2mol/L的草酸溶液20mL恰好反应生成草酸钠,醋酸根离子易水解而使其溶液呈碱性,但第一步水解大于第二步,两步水解都生成氢氧根离子,所以溶液中阴离子浓度大小顺序是
c(C2O42-)>c(OH-)>c(HC2O4-),
故答案为:c(C2O42-)>c(OH-)>c(HC2O4-);
(4)由于利用高锰酸钾溶液进行滴定来测量亚铁离子的含量,加入的酸不能具有氧化性,所以不可以用硝酸;盐酸中的氯离子具有还原性,能够被高锰酸钾氧化,对测定结果产生影响,所以不可以用盐酸;
故实验中所用的KMO4溶液要进行酸化,用于酸化的酸是:稀硫酸,
酸性高锰酸钾和草酸反应生成锰离子、二氧化碳和水,离子反应方程式为:6H++2 MnO4-+5H2C2O4═10CO2↑+2Mn2++8H2O,
故答案为:稀硫酸;6H++2 MnO4-+5H2C2O4═10CO2↑+2Mn2++8H2O;
(5)草酸钙在水溶液里存在电离平衡,向溶液中加水时,溶液中草酸根离子和钙离子浓度都减小,导致平衡向正反应方向移动,从而加速结石消融,
故答案为:CaC2O4(s)?C2O42-(aq)+Ca2+(aq);多饮水使平衡向溶解方向移动,从而加速结石消融;
(6)根据电离平衡常数可知:H2C2O4>H2CO3>HCO3-,故往Na2CO3溶液中加入少量草酸溶液,反应生成HCO3-和C2O42-,故离子方程式为:2CO32-+H2C2O3=2HCO3-+C2O42-,故答案为:2CO32-+H2C2O3=2HCO3-+C2O42-;
(7)25℃时,向20mL碳酸钙的饱和溶液中逐滴加入c mol/L的草酸钾溶液20mL后,有草酸钙沉淀生成;
碳酸钙的Ksp=2.5×10-9=c(Ca2+)c(CO32-),饱和溶液中钙离子浓度c(Ca2+)=5×10-5mol/L,等体积混合后溶液中c(Ca2+)=2.5×10-5mol/L,草酸钙的Ksp=4.0×10-8 =c(Ca2+)c(C2O42-)=2.5×10-5mol/L×$\frac{c}{2}$mol/L,
c=$\frac{4×1{0}^{-8}×2}{2.5×1{0}^{-5}}$=3.2×10-3,
故答案为:3.2×10-3.
点评 本题考查了弱电解质的电离、难溶物的溶解平衡,明确弱电解质电离特点及溶度积常数的运用是解本题关键,难度中等.


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:选择题
 .已知有机物X的键线式为
.已知有机物X的键线式为 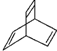 ,Y是X的同分异构体且属于芳香烃.下列关于Y的说法正确的是( )
,Y是X的同分异构体且属于芳香烃.下列关于Y的说法正确的是( )| A. | Y的结构简式为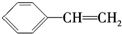 | |
| B. | Y能使溴水褪色,且反应后的混合液静置后不分层 | |
| C. | Y不能发生取代反应 | |
| D. | Y分子中的所有原子一定共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低温度能减慢反应速率 | |
| B. | 单质碳的颗粒变小能加快反应速率 | |
| C. | 增大H2O蒸气的浓度能加快反应速率 | |
| D. | 加入足量的C能使H2O反应完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上利用电解法冶炼铝和铁 | |
| B. | 生产和生活中常用可溶性铝盐和铜盐净水 | |
| C. | 工业合成氨的反应属于能自发进行的反应,故能迅速发生 | |
| D. | 热的纯碱溶液清洗带油污的餐具与盐类和酯类的水解均有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H6和2-甲基1-丁烯 | |
| B. | 3,3-二甲基-1-丁炔和3-甲基1-戊炔 | |
| C. |  和 和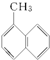 | |
| D. | C4H10和C9H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
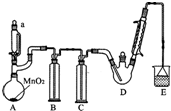 某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径由大到小的顺序:Z、X、Y | |
| B. | 元素非金属性由强到弱的顺序:W、Z、Y | |
| C. | 简单气态氢化物的稳定性由强到弱的顺序:Z、W | |
| D. | W分别与X、Y形成的化合物化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com