
 如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )
如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )| 选项 | 气体 | A中试剂 | B中试剂 |
| A | SO2、CO2 | 酸性KMnO4溶液 | 品红溶液 |
| B | Cl2、HCl | 浓硫酸 | KI淀粉溶液 |
| C | NH3、CO2 | 浓硫酸 | 酚酞试液 |
| D | C2H4、CH4 | 酸性KMnO4溶液 | 溴的CCl4溶液 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.KMnO4溶液有强氧化性,能与还原性的物质反应;
B.浓硫酸可以干燥酸性和中性气体,氧化性物质能使淀粉碘化钾试纸变蓝;
C.酚酞在酸性和中性条件下呈无色,碱性条件下呈红色;
D.乙烯有还原性能使KMnO4溶液褪色.
解答 解:A.KMnO4溶液有强氧化性,能吸收有还原性的二氧化硫,与二氧化碳不反应,二氧化碳不能使品红褪色,故A错误;
B.浓硫酸与Cl2、HCl不反应,氯气有强氧化性,能使淀粉碘化钾试纸变蓝,故B正确;
C.浓硫酸可吸收氨气,与二氧化碳不反应,二氧化碳的水溶液呈弱酸性,不能使酚酞变色,故C错误;
D.KMnO4溶液可将乙烯氧化为二氧化碳,KMnO4溶液与甲烷不反应,二氧化碳,甲烷与溴的CCl4溶液不反应,故D错误.
故选B.
点评 本题考查了常见元素及其化合物的性质,主要考查了高锰酸钾的氧化性、浓硫酸的酸性和吸水性、氯气、二氧化碳等物质的性质,题目难度不大,注意掌握指示剂的变色范围.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 Ⅰ.物质的量浓度相同的 ①氨水 ②氯化铵 ③碳酸氢铵 ④硫酸氢铵 ⑤硫酸铵 五种溶液中c(NH4+)大小的顺序是(填序号)⑤>④>②>③>①
Ⅰ.物质的量浓度相同的 ①氨水 ②氯化铵 ③碳酸氢铵 ④硫酸氢铵 ⑤硫酸铵 五种溶液中c(NH4+)大小的顺序是(填序号)⑤>④>②>③>①查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)(放热反应),图中曲线b代表一定条件下该反应的过程,若使曲线b变为曲线a,可采取的措施是( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)(放热反应),图中曲线b代表一定条件下该反应的过程,若使曲线b变为曲线a,可采取的措施是( )| A. | 增大A的浓度 | B. | 增大C的浓度 | C. | 加入催化剂 | D. | 升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量时托盘上要垫上干净的称量纸 | |
| B. | 移液时不慎有部分液体溅出,会造成所配溶液浓度偏小 | |
| C. | 定容时俯视容量瓶刻度线,会造成所配溶液浓度偏大 | |
| D. | 定容摇匀后发现液面下降,不应再加蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3p轨道上有2个未成对电子的原子和4p轨道上有2个未成对电子的原子 | |
| B. | 3p轨道上只有1个空轨道的原子和4p轨道上只有1个空轨道的原子 | |
| C. | 最外层电子排布为1s2的原子和最外层电子排布为2s2的原子 | |
| D. | 最外层电子排布为3s2的原子和最外层电子排布为4s2的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
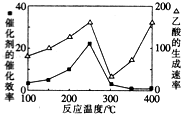 CO2和CH4是两种主要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究目标.
CO2和CH4是两种主要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究目标.| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com