
__________________________________________
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| 实验编号 | 氨水物质的量浓度 (mol?L-1) |
盐酸物质的量浓度 (mol?L-1) |
混合溶液pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | C | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 离地面高度(m) | 0.8 | 1.0 | 1.2 | 1.4 | 1.6 | 1.8 | 2.0 |
| 空气中铅的浓度(μg/m3) | 1.10 | 0.98 | 0.91 | 0.72 | 0.66 | 0.54 | 0.50 |
| 化学处理 |
| K2CrO4 |
| 过滤 |
| 洗涤 |
| a |
| 称量 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省青岛市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
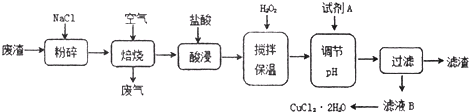
(Ⅰ)铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜(含杂质Fe)与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
(1)固体A用稀盐酸溶解的原因是 ;
(2)检验溶液B中是否存在Fe3+的方法是 ;
(3)已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是 ;
(Ⅱ)(1) 常温下,某同学将稀盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
|
实验编号 |
氨水物质的量浓度 (mol·L-1) |
盐酸物质的量浓度 (mol·L-1) |
混合溶液 pH |
|
① |
0.1 |
0.1 |
pH=5 |
|
② |
C |
0.2 |
pH=7 |
|
③ |
0.2 |
0.1 |
pH>7 |
请回答:从第①组情况分析,该组所得混合溶液中由水电离出的c(H+)= mol·L-1;从第②组情况表明,C 0.2 mol·L-1(选填“>”、“<”或“=”);从第③组情况分析可知,混合溶液中c(NH4+)
c(NH3·H2O)(选填“>”、“<”或“=”)。
(2)写出以下四组溶液NH4+离子浓度由大到小的顺序 > > > (填选项编号)。
A.0.1mol·L-1NH4Cl
B.0.1mol·L-1NH4Cl和0.1mol·L-1NH3·H2O
C.0.1mol·L-1NH3·H2O
D.0.1mol·L-1NH4Cl和0.1mol·L-1HCl
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:实验题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com