
【题目】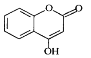 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成。
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成。
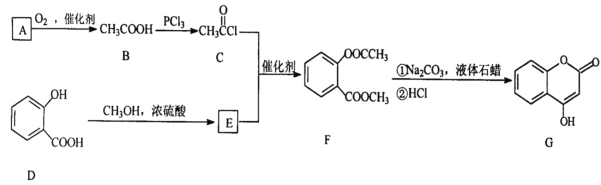
请回答下列问题:
(1)A与银氨溶液反应有银镜生成,则A的结构简式是__________________
(2)B→C的反应类型是______________
(3)写出F和过量NaOH溶液共热时反应的化学方程_______________________________
(4)下列关于G的说法正确的是______________
a.能与溴单质反应
b.能与金属钠反应
c.1molG最多能和3mol氢气反应
d.分子式是C9H7O3
(5)与D互为同分异构体且含有酚羟基、酯基的有_____________种
(6)根据已学知识和获取的信息,写出以CH3COOH,![]() 为原料合成重要的化工产品
为原料合成重要的化工产品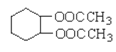 的路线流程图__________________________(无机试剂任选)合成路线流程图示例如下:CH3CH2OH
的路线流程图__________________________(无机试剂任选)合成路线流程图示例如下:CH3CH2OH![]() CH2=CH2
CH2=CH2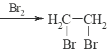
【答案】CH3CHO 取代反应  +3NaOH
+3NaOH  +CH3COONa+CH3OH+H2O a、b 三种
+CH3COONa+CH3OH+H2O a、b 三种 
【解析】
A与银氨溶液反应有银镜生成,被氧化生成乙酸,则A为CH3CHO;B中羟基被氯原子取代生成C;D和甲醇在浓硫酸作用下发生酯化反应生成E,则E的结构简式为E为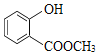 ;C与E在催化剂作用下发生取代反应生成F,F经系列反应生成G。
;C与E在催化剂作用下发生取代反应生成F,F经系列反应生成G。
(1)根据分析可知A为CH3CHO;
(2)对比B和C的结构简式,B中羟基被氯原子取代生成C,所以为取代反应;
(3)F含有酯基可以在NaOH溶液中水解,水解后产生羧基和酚羟基和NaOH溶液反应,所以化学方程式为 +3NaOH
+3NaOH  +CH3COONa+CH3OH+H2O;
+CH3COONa+CH3OH+H2O;
(4)a.G中含有碳碳双键,所以能与溴单质反应,故a正确;
b.G中含有醇羟基,所以能与金属钠反应生成氢气,故b正确;
c.苯环和碳碳双键均可以和氢气加成,1molG最多能和4mol氢气反应,故c错误;
d.分子式是C9H6O3,故d错误;
故选:ab;
(5)与D互为同分异构体且含酚羟基、属于酯类,则应为甲酸酯,苯环上有酚羟基和酯基有邻、间、对三种结构;
(6)以CH3COOH,![]() 为原料合成重要的化工产品
为原料合成重要的化工产品![]() ,应先制备
,应先制备![]() ,可由
,可由![]() 经消去、加成、水解后生成,则反应的流程为
经消去、加成、水解后生成,则反应的流程为 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】聚乙炔导电聚合物的合成使高分子材料进入了“合成金属”和塑料电子学时代,当聚乙炔分子带上药物、氨基酸等分子片段后,就具有了一定的生物活性。以下是我国化学家近年来合成的聚乙炔衍生物分子M的结构式及M在稀硫酸作用下的水解过程。下列有关说法中不正确的是( )
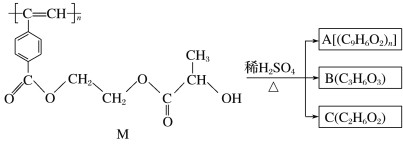
A.M与A均能使酸性高锰酸钾溶液和溴水褪色
B.1 mol M与热的烧碱溶液反应,可消耗2n mol的NaOH
C.A、B、C各1 mol分别与足量金属钠反应,放出的气体的物质的量之比为1∶2∶2
D.B在一定条件下能发生缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个电化学过程的示意图,请按要求填空:

(1)通入CH3CH2OH的电极名称是______________,B电极的名称是_____________。
(2)通入CH3CH2OH一极的电极反应式为_____________________________________。
(3)乙池中总反应的化学方程式为___________________________________________。
(4)当乙池中A(Fe)极的质量增加12.8g时,甲池中消耗O2 _______ mL(标况下)
(5)火箭发射时可用肼(N2H4)为燃料,以二氧化氮做氧化剂,它们相互反应生成氮气和水蒸气。
①写出在碱性条件下负极反应式为:___________________________________________。
②已知:N2(g)+2O2(g)=2NO2(g),ΔH=+67.7 kJ·mol-1;N2H4(g)+O2(g)=N2(g)+2H2O(g),ΔH=-534 kJ·mol-1,则N2H4和NO2反应的热化学方程式__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 实验结论 |
(1)称取A4.5g,升温使其汽化,测其密度是相同条件下H2的45倍。 | A的相对分子质量为:___。 |
(2)将此4.5gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重2.7g和6.6g。 | A的分子式为:___。 |
(3)另取A4.5g,跟足量的NaHCO3粉末反应,生成1.12LCO2(标准状况),若与足量金属钠反应则生成1.12LH2(标准状况)。 | 写出A中含有的官能团___、__。 |
(4)A的核磁共振氢谱如图: | 综上所述,A的结构简式为___。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学是预防污染的根本手段,它的目标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各个环节中都实现净化和无污染。
(1)下列各项符合“绿色化学”要求的是________(填序号)。
A.处理废弃物 B.治理污染点 C.减少有毒物 D.杜绝污染源
(2)某化工厂排放的污水中含有![]() 、
、![]() 、
、![]() 、
、![]() 四种离子。某同学设计了从该污水中回收金属铜的方案。
四种离子。某同学设计了从该污水中回收金属铜的方案。
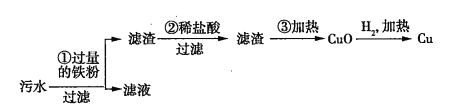
在回收金属铜的方案中,操作_______会导致环境污染,为防止污染,应采取的措施是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前生产聚氯乙烯的方法是先使乙烯与氯气和氧气在一定条件下反应生成氯乙烯和水,再进一步合成聚氯乙烯。请回答
(1)请写出上述两个过程所发生反应的化学方程式:①____________________________,②__________________________________________。
(2)聚氯乙烯是一种可燃物,火灾中聚氯乙烯燃烧会产生有害气体,其主要成分可能是_________;若在火灾现场,为了防止气体中毒,应采取的防护措施是__________________________________________。
(3)聚氯乙烯___________(填“可以”或“不可以”)用于制作食品包装袋,原因是______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据科技日报网报道南开大学科研团队借助镍和苯基硼酸共催化剂,首次实现丙烯醇高效、绿色合成。丙烯醇及其化合物可合成甘油、医药、农药、香料,合成维生素E和KI及天然抗癌药物紫杉醇中都含有关键的丙烯醇结构。丙烯醇的结构简式为CH2=CH-CH2OH。请回答下列问题:
(1)基态镍原子的电子排布式为___。
(2)1molCH2=CH-CH2OH中σ键和π键的个数比为___,丙烯醇分子中碳原子的杂化类型为___。
(3)丙醛(CH3CH2CHO的沸点为49℃,丙烯醇(CH2=CHCH2OH)的沸点为91℃,二者相对分子质量相等,沸点相差较大的主要原因是___。
(4)羰基镍[Ni(CO)4]用于制备高纯度镍粉,它的熔点为-25℃,沸点为43℃。羰基镍晶体类型是___。
(5)Ni2+能形成多种配离子,如[Ni(NH3)6]2+、[Ni(SCN)3]-和[Ni(CN)2]2-等。[Ni(NH3)6]2+中心原子的配位数是___,与SCN-互为等电子体的分子为___。
(6)“NiO”晶胞如图所示。
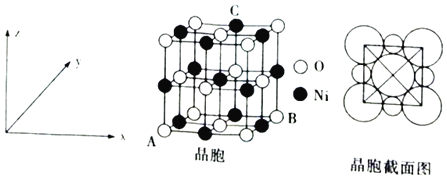
①氧化镍晶胞中原子坐标参数:A(0,0,0)、B(1,1,0),则C原子坐标参数为___。
②已知:氧化镍晶胞密度为dgcm-3,NA代表阿伏加德罗常数的值,则Ni2+半径为___nm(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的产量是衡量一个国家石油化工水平的重要标志。聚乙烯是以乙烯为原料合成的一种人们常用的高分子材料。下列有关叙述正确的是( )
A.乙烯合成聚乙烯的反应属于化合反应
B.乙烯合成聚乙烯的化学方程式是:nCH2=CH2 ![]()
![]()
C.聚乙烯在自然界中很难降解,容易导致“白色污染”
D.聚乙烯是纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,且所含碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图所示:
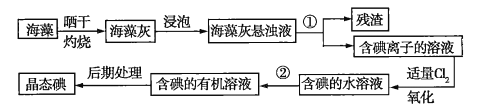
(1)指出制取碘的过程中有关实验操作的名称:①__________,②__________。
(2)操作②中可供选择的有机试剂是_________(填序号)。
A.甲苯、酒精 B.四氯化碳、苯 C.汽油、乙酸 D.汽油、甘油
(3)现需做使海藻灰中的碘离子转化为有机溶液中的碘单质的实验,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、药品,尚缺少的玻璃仪器是__________、___________。
(4)要从碘的苯溶液中提取碘和回收苯,还需要经过蒸馏操作。进行蒸馏操作时,需使用水浴加热,目的是__________,最后晶态碘在________中聚集。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com