
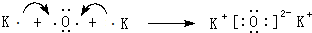 .
. 分析 A、B、C、D是原子序数小于20的四种元素,B元素最高正价的绝对值与负价的绝对值之差等于6,则B为第ⅦA族元素,F元素没有正化合价,所以B为氯元素;A元素+1价的阳离子与B、D的阴离子具有相同的电子层结构,即核外电子数为18,则A为K元素;lmolC单质与足量的稀硫酸反应可生成1.5molH2,则C为金属,根据电子转移守恒可知,C原子最外层电子数为3,可推知C为Al;D元素原子的最外层电子数是C元素原子的最外层电子数的2倍,故D原子最外层电子数为6,D离子核外电子数为18,则D为S元素,据此解答.
解答 解:A、B、C、D是原子序数小于20的四种元素,B元素最高正价的绝对值与负价的绝对值之差等于6,则B为第ⅦA族元素,F元素没有正化合价,所以B为氯元素;A元素+1价的阳离子与B、D的阴离子具有相同的电子层结构,即核外电子数为18,则A为K元素;lmolC单质与足量的稀硫酸反应可生成1.5molH2,则C为金属,根据电子转移守恒可知,C原子最外层电子数为3,可推知C为Al;D元素原子的最外层电子数是C元素原子的最外层电子数的2倍,故D原子最外层电子数为6,D离子核外电子数为18,则D为S元素.
(1)由上述分析可知,A、B、C、D四种元素依次是:钾、氯、铝、硫,
故答案为:钾、氯、铝、硫;
(2)A与C最高价氧化物对应水化物分别为KOH、Al(OH)3,金属性K>Al,故碱性:KOH>Al(OH)3,
B与D最高价氧化物的水化物分别为HClO4、H2SO4,非金属性Cl>S,故酸性:HClO4>H2SO4,
故答案为:碱性:KOH>Al(OH)3,酸性:HClO4>H2SO4;
(3)A与C最高价氧化物对应水化物分别为KOH、Al(OH)3,二者反应生成偏铝酸钾与水,反应方程式为:KOH+Al(OH)3=KAlO2+2H2O,
故答案为:KOH+Al(OH)3=KAlO2+2H2O;
(4)用电子式表示化合物K2O的形成过程: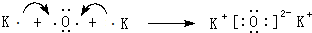 ,
,
故答案为: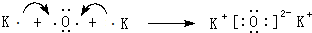 .
.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意掌握电子式表示化学键或物质的形成.


科目:高中化学 来源: 题型:选择题
| A. | NaNO2 NO H2O | B. | NaNO3 NaOH O2 H2O | ||
| C. | NaNO3 H2O | D. | NaNO3 HNO3 O2 H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=+57.3kJ/mol | |
| C. | S(s)+O2(g)═SO2(g);△H=-296.8kJ/mol | |
| D. | 2NO2═O2+2NO;△H=+116.2kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第二周期元素从C到F,非金属性逐渐减弱 | |
| B. | 第三周期元素从Na到Cl,原子半径逐渐增大 | |
| C. | HF、HCl、HBr、HI的热稳定性依次逐渐增强 | |
| D. | LiOH、NaOH、KOH的碱性依次逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大 | |
| B. | 加入少量Na2SO3固体,则c(H+)+c(Na+)=c(HSO3-)+c(OH-)+$\frac{1}{2}$c(SO32-) | |
| C. | 加入少量NaOH溶液,$\frac{c(S{O}_{3}^{2-})}{c(HS{O}_{3}^{-})}$、$\frac{c(O{H}^{-})}{c({H}^{+})}$的值均增大 | |
| D. | 加入氨水至中性,则2c(Na+)=c(SO32-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78g Na2O2固体中所含阴阳离子个数均为2NA | |
| B. | 1.5g CH3+中含有的电子数为0.9NA | |
| C. | 3.4g氨气中含0.6NA个N-H键 | |
| D. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥ | B. | ①④⑤ | C. | ①②③④ | D. | ①③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com