
����Ŀ����֪A��B��C��D��E��F��G����Ԫ�����ڱ��ж���������Ԫ�أ����ǵ�ԭ��������������A��Ԫ�����ڱ���ԭ�Ӱ뾶��С��Ԫ�أ�D3B�����������Ӿ�����ͬ�ĵ��Ӳ�ṹ��Bԭ��������Ӳ��p�ܼ����ڰ���״̬��Cԭ��������p�ܼ���������s�ܼ���������2����C��F����ͬһ���壬E���������������ڲ��1���ش��������⣺
��1��EԪ�ػ�̬ԭ�ӵĵ����Ų�ʽΪ___��
��2���õ����Ų�ͼ��ʾFԪ��ԭ�ӵļ۵����Ų���____��
��3��F��GԪ�ض�Ӧ����ۺ����������Խ�ǿ����___(�ѧʽ)��
��4�����Ӱ뾶��D+___(����<����>��������������ͬ)B3-����һ�����ܣ�B___C���縺�ԣ�C__F��
��5��A��C�γɵ�һ����ɫ������X�й㷺Ӧ�ã�X������A��Cԭ�Ӹ�����Ϊ1��1��X�ĵ���ʽΪ___����д��Cu��ϡ������X��Ӧ�Ʊ�����ͭ�����ӷ���ʽ��__��
��6��д��E�ĵ�����D������������Ӧ��ˮ���ﷴӦ�Ļ�ѧ����ʽ��____��
���𰸡�1s22s22p63s23p1 ![]() HClO4 < > >
HClO4 < > > ![]() Cu+2H++H2O2=Cu2++2H2O 2Al+2H2O+2NaOH=2NaAlO2+3H2��
Cu+2H++H2O2=Cu2++2H2O 2Al+2H2O+2NaOH=2NaAlO2+3H2��
��������
![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ����Ԫ�����ڱ��ж���������Ԫ�أ����ǵ�ԭ��������������
����Ԫ�����ڱ��ж���������Ԫ�أ����ǵ�ԭ��������������![]() �����ڱ���ԭ�Ӱ뾶��С��Ԫ�أ���
�����ڱ���ԭ�Ӱ뾶��С��Ԫ�أ��� ![]() ��
�� ![]() Ԫ�أ�
Ԫ�أ�![]() �����������Ӿ�����ͬ�ĵ��Ӳ�ṹ��
�����������Ӿ�����ͬ�ĵ��Ӳ�ṹ��![]() ԭ��������Ӳ��
ԭ��������Ӳ�� ![]() �ܼ��ϵĵ��Ӵ��ڰ���״̬��Ϊ��VA ��Ԫ�أ�
�ܼ��ϵĵ��Ӵ��ڰ���״̬��Ϊ��VA ��Ԫ�أ�![]() Ϊ
Ϊ ![]() �ۡ�
�ۡ�![]() Ϊ
Ϊ ![]() ����
���� ![]() �ǽ���Ԫ�أ�
�ǽ���Ԫ�أ�![]() ��ԭ����������
��ԭ���������� ![]() ��
��![]() ����
���� ![]() Ϊ
Ϊ ![]() Ԫ�ء�
Ԫ�ء�![]() Ϊ
Ϊ ![]() Ԫ�أ�Cԭ��������p�ܼ���������s�ܼ���������2������
Ԫ�أ�Cԭ��������p�ܼ���������s�ܼ���������2������ ![]() ��
�� ![]() Ԫ�أ�
Ԫ�أ�![]() ��
��![]() ��ͬһ���壬��
��ͬһ���壬�� ![]() ��
�� ![]() Ԫ�أ�
Ԫ�أ�![]() ���������������ڲ��
���������������ڲ�� ![]() ����
���� ![]() ����������Ϊ
����������Ϊ ![]() ��
��![]() ��
�� ![]() Ԫ�أ�
Ԫ�أ�![]() ��ԭ����������
��ԭ���������� ![]() ����Ϊ����������Ԫ�أ���
����Ϊ����������Ԫ�أ��� ![]() ��
�� ![]() Ԫ�ء�
Ԫ�ء�
��1��ͨ�����Ϸ���֪��![]() ��
�� ![]() Ԫ�أ���ԭ�Ӻ����� 13 �����ӣ����ݹ���ԭ��֪���̬ԭ�Ӻ�������Ų�ʽΪ
Ԫ�أ���ԭ�Ӻ����� 13 �����ӣ����ݹ���ԭ��֪���̬ԭ�Ӻ�������Ų�ʽΪ ![]() ��
��
��2��![]() Ϊ
Ϊ ![]() Ԫ�أ���۵���Ϊ
Ԫ�أ���۵���Ϊ ![]() ��
��![]() ���ӣ���۵����Ų�ͼΪ
���ӣ���۵����Ų�ͼΪ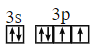 ��
��
��3��Ԫ�صķǽ�����Խǿ��������������ˮ��������Խǿ��![]() Ԫ�صķǽ����Դ���
Ԫ�صķǽ����Դ��� ![]() Ԫ�أ���
Ԫ�أ��� ![]() Ԫ�ض�Ӧ����ۺ����������Խ�ǿ�ķ���ʽΪ
Ԫ�ض�Ӧ����ۺ����������Խ�ǿ�ķ���ʽΪ ![]() ��
��
��4�����Ӳ�ṹ��ͬ�����ӣ����Ӱ뾶����ԭ���������������С���������Ӱ뾶 ![]() ��
��![]() ��
�� ![]() Ԫ�ء�
Ԫ�ء�![]() ��
�� ![]() Ԫ�أ�ͬһ����Ԫ���У�Ԫ�ص�һ����������ԭ����������������������ƣ�������
Ԫ�أ�ͬһ����Ԫ���У�Ԫ�ص�һ����������ԭ����������������������ƣ�������![]() ��Ԫ�ص�һ�����ܴ�������Ԫ�أ����Ե�һ������
��Ԫ�ص�һ�����ܴ�������Ԫ�أ����Ե�һ������ ![]() ��
��![]() ��
�� ![]() Ԫ�ء�
Ԫ�ء�![]() ��
�� ![]() Ԫ�أ�ͬһ����Ԫ���У��縺������ԭ���������������С�����Ե縺��
Ԫ�أ�ͬһ����Ԫ���У��縺������ԭ���������������С�����Ե縺�� ![]() ��
��
��5��![]() ��
��![]() �γɵ�һ����ɫ������
�γɵ�һ����ɫ������ ![]() �й㷺Ӧ�ã�
�й㷺Ӧ�ã�![]() ������
������ ![]() ��
��![]() ԭ�Ӹ����� 1:1����
ԭ�Ӹ����� 1:1���� ![]() ��˫��ˮ�������ʽΪ
��˫��ˮ�������ʽΪ![]()
![]() �����������£�˫��ˮ��ͭ����Ϊͭ���ӣ����ӷ���ʽΪ
�����������£�˫��ˮ��ͭ����Ϊͭ���ӣ����ӷ���ʽΪ ![]() ��
��
��6��![]() ������������ˮ������
������������ˮ������ ![]() ����������������Һ��Ӧ����ƫ�����ƺ���������Ӧ����ʽʽΪ
����������������Һ��Ӧ����ƫ�����ƺ���������Ӧ����ʽʽΪ ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������þ![]() ����������������ݼ��ȣ�ʵ�����Ʊ�����
����������������ݼ��ȣ�ʵ�����Ʊ�����![]() ��������ͼ1��
��������ͼ1��
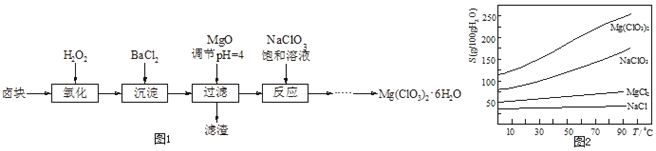
��֪��
![]() ±����Ҫ�ɷ�Ϊ
±����Ҫ�ɷ�Ϊ![]() ������
������![]() ��
��![]() �����ʣ�
�����ʣ�
![]() ���ֻ�������ܽ��
���ֻ�������ܽ��![]() ���¶�
���¶�![]() �仯������ͼ2��
�仯������ͼ2��
![]() ��MgO�����������������Ҫ�ɷ�Ϊ______��
��MgO�����������������Ҫ�ɷ�Ϊ______��
![]() ����
����![]() ��Ŀ���dz�ȥ
��Ŀ���dz�ȥ![]() ����μ���
����μ���![]() �ѳ�����ȫ______��
�ѳ�����ȫ______��
![]() ����
����![]() ������Һ�ᷢ�����·�Ӧ��
������Һ�ᷢ�����·�Ӧ��![]() �������ø÷�Ӧ�����ͼ1����ȡ
�������ø÷�Ӧ�����ͼ1����ȡ![]() ��ʵ�鲽������Ϊ��
��ʵ�鲽������Ϊ��
![]() ȡ��������
ȡ��������![]() ������Һ��ַ�Ӧ��
������Һ��ַ�Ӧ��
![]() ______��
______��
![]() ______��
______��
![]() ______��
______��
![]() ���ˡ�ϴ�ӣ����
���ˡ�ϴ�ӣ����![]() ���壮
���壮
��Ʒ��![]() �����IJⶨ��
�����IJⶨ��
����1��ȷ����![]() ��Ʒ�ܽⶨ�ݳ�100mL��Һ��
��Ʒ�ܽⶨ�ݳ�100mL��Һ��
����2��ȡ10mL����ƿ�У�����10mLϡ�����![]() ��
��![]() ��Һ���ȣ�
��Һ���ȣ�
����3����ȴ�����£���![]() ��Һ�ζ����յ㣬�˹����з�Ӧ�����ӷ���ʽΪ��
��Һ�ζ����յ㣬�˹����з�Ӧ�����ӷ���ʽΪ��![]()
����4��������2��3�ظ����Σ�ƽ������![]() ��Һ
��Һ![]() ��
��
![]() ������Ʒ�ⶨ����Ҫ����Ƿ�©Һ��������______
������Ʒ�ⶨ����Ҫ����Ƿ�©Һ��������______![]() ����3�����ζ�ǰ���ñ�Һ��ϴ�ζ��ܣ��ᵼ�����ս��ƫ______
����3�����ζ�ǰ���ñ�Һ��ϴ�ζ��ܣ��ᵼ�����ս��ƫ______![]() ������������С��
��������������![]() ��
��
![]() ��Ʒ��
��Ʒ��![]() ����������Ϊ______
����������Ϊ______![]() ������������λС��
������������λС��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС���������ͼ��ʾ�����ֻ�ʵ��װ�ã��о������£���1L0.1mol/L H2A��Һ����μ����Ũ��NaOH��Һʱ��pH�仯����������Ƴ���Һ�к�AԪ�ص��������ʵ�����������ҺpH�Ĺ�ϵ��ͼ��ʾ��������˵��������ȷ���ǣ� ��
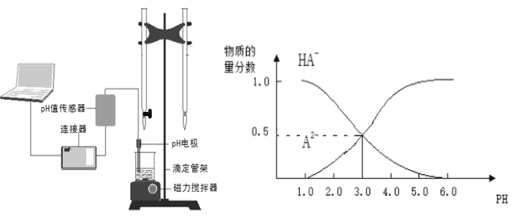
A��pH=4.0ʱ��ͼ��n(HA��)ԼΪ0.0091mol
B����ʵ��Ӧ����ߵ���ʽ�ζ��ܻ����ұ�ʽ�ζ��ܲ��ӷ�̪��ָʾ��
C�������£������ʵ���Ũ�ȵ�NaHA��Na2A��Һ�������Ϻ���ҺpH=3.0
D��0.1mol/LNaHA��Һ�д���c(A2��)��c(HA��)��c(H2A)��0.1mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ܱ������У���ӦaA��g���PbB��g����ƽ������¶Ȳ��䣬�������������һ�������ﵽ�µ�ƽ��ʱ��B��Ũ����ԭ����60%���� ��
A.ƽ��������Ӧ�����ƶ���B.����A��ת���ʼ�����
C.����B��������������D.a>b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ļ������ڻ���������Ӧ�÷dz��㷺.�Իش��������⣺
��1���������������������ҿ������������е��ʷ�Ӧ��
��֪��6Ag��s��+O3��g���T3Ag2O��s������H=��235kJ/mol��
2Ag2O��s���T4Ag��s��+O2��g������H=+60kJ/mol��
��Ӧ2O3��g��=3O2��g������H=___��
��2��SO2Cl2����������ҽҩƷ��Ⱦ�ϡ�������Լ���.��֪��SO2Cl2��g��![]() SO2��g��+Cl2��g����H=akJmol��1��300��ʱ�����Ϊ2L�ĺ����ܱ������г���0.20molSO2Cl2���ﵽƽ��ʱ�������к�0.1molSO2�����¶�ʱ��Ӧ��ƽ�ⳣ��Ϊ___�����������û��������������BaCl2��Һ�У��������ɳ���������Ϊ___��
SO2��g��+Cl2��g����H=akJmol��1��300��ʱ�����Ϊ2L�ĺ����ܱ������г���0.20molSO2Cl2���ﵽƽ��ʱ�������к�0.1molSO2�����¶�ʱ��Ӧ��ƽ�ⳣ��Ϊ___�����������û��������������BaCl2��Һ�У��������ɳ���������Ϊ___��
��3���ԣ�2���еķ�Ӧ����400�棬1.01��105Pa�����£����ݻ�Ϊ2L�ĺ����ܱ������г���һ������SO2Cl2��n��SO2����n��SO2Cl2����ʱ��ı仯������ͼ��ʾ��
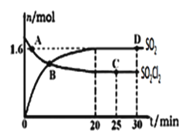
��0��20min��Ӧ��ƽ������v��SO2Cl2��=___����H___0(����<����>����������)��ԭ���ǣ�___��
������������ȷ����___��
A.A��v����SO2Cl2����v����SO2Cl2��
B.�ܶȺ�ƽ��Ħ�����������˵������ƽ��״̬
C.�����������䣬������ѹǿ��n��SO2����ͼ��D���ֵ��
D.�����������䣬500��ʱ��Ӧ��ƽ�⣬n��SO2����ͼ��D���ֵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ֽ�1.92gCuͶ�뵽һ������ŨHNO3�У�Cu��ȫ�ܽ⣬����������ɫԽ��Խdz�����ռ�����״����672mL��NOX������壬��ʢ�д����������������ˮ���У�ͨ���״����һ�������O2��ǡ��ʹ������ȫ����ˮ����ͨ���״���µ�O2�����Ϊ�� ��
A. 504mLB. 336mLC. 224mLD. 168mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���![]() ��Һ���ֱ�ζ�
��Һ���ֱ�ζ�![]() Ũ�Ⱦ�Ϊ
Ũ�Ⱦ�Ϊ![]() ��Һ��HCN��Һ�����õζ�������ͼ������˵����ȷ����
��Һ��HCN��Һ�����õζ�������ͼ������˵����ȷ����![]()

A.��![]() �͵�
�͵�![]() ��ʾ��Һ�У�
��ʾ��Һ�У�![]()
B.����ĵζ��յ���![]()
C.�ζ�![]() �����в����ܳ��֣�
�����в����ܳ��֣�![]()
D.�ζ�HCN�����п����÷�̪��Һָʾ�յ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ2SO2 + O2 ![]() 2SO3�ǹ�ҵ��������Ĺؼ����裬����˵������ȷ��
2SO3�ǹ�ҵ��������Ĺؼ����裬����˵������ȷ��
A.ʵ�������У��˷�Ӧ�ڽӴ��ҽ���
B.�������������SO2��ת����
C.ʹ�ô�������߸÷�Ӧ�ķ�Ӧ����
D.2molSO2��1molO2���һ��������2molSO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڱ�ǰ�����ڵ�Ԫ��a��b��c��d��e��ԭ��������������a��b�����������������Ԫ�أ�c�ǵؿ��к�������Ԫ�أ�d��bͬ�壬e2+���ӵ�3d�������9�����ӡ��ش��������⣺
(1)c��d����Ԫ���γɵĻ�����ͳ�ƹ�ʯ����ͨ��______________����������ᾧ�κ����ε����ִ�����̬��c�ļ۵����Ų�ͼΪ______________________________��
(2)A��B�����������ֳ������л��A����CaCO3��Ӧ�������ڳ�����ˮ����B�����е�̼ԭ����Ŀ��A����ͬ�������Ʒ�Ӧ�ų����塣B�д��ڵĻ�ѧ��������______��
A.���Ӽ� B.���ۼ� C.������ D.���
A������̼ԭ�ӵĹ���ӻ�������___________��
(3)����>������<����գ�
��һ������ | �۵� |
b___d | dc2����___d���� |
(4)c��e����Ԫ�ؿ��γ�һ�ְ뵼����ϣ���ѧʽΪe2c���������������ڲ����ĸ�cԭ�ӣ�����cԭ��λ�����ĺͶ��㣬��þ�������____��eԭ�ӡ�
(5)��e2+�����ε�ˮ��Һ�м�������İ�ˮ���ɵõ�����ɫ����Һ��д�����������ӵĽṹ______________(Ҫ����λ��)��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com