
【题目】某溶液可能含有Cl-、SO![]() 、CO
、CO![]() 、NH
、NH![]() 、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时观察到红褐色沉淀,过滤,洗涤,灼烧,得到1.6g固体:向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中( )
、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时观察到红褐色沉淀,过滤,洗涤,灼烧,得到1.6g固体:向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中( )
A.CO![]() 、Al3+一定不存在,K+可能存在
、Al3+一定不存在,K+可能存在
B.Cl-一定存在,且c(Cl-)=0.4mol/L
C.SO![]() 、NH
、NH![]() 一定存在,CO32-可能存在
一定存在,CO32-可能存在
D.原溶液中至少存在上述离子中的4种
【答案】D
【解析】
加入过量NaOH溶液,加热,得到0.02mol气体,说明原溶液含有NH![]() ,且n(NH
,且n(NH![]() )=0.02mol,同时观察到红褐色沉淀,说明原溶液含有Fe3+,过滤,洗涤,灼烧,得到1.6g固体为Fe2O3,且可知
)=0.02mol,同时观察到红褐色沉淀,说明原溶液含有Fe3+,过滤,洗涤,灼烧,得到1.6g固体为Fe2O3,且可知![]() ,同时说明不含CO
,同时说明不含CO![]() ,向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀为BaSO4,且n=0.02mol,又溶液中必须电荷守恒,即n(NH
,向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀为BaSO4,且n=0.02mol,又溶液中必须电荷守恒,即n(NH![]() )+3n(Fe3+)=2n(SO
)+3n(Fe3+)=2n(SO![]() ),带入数据发现,溶液中至少还有0.04mol的Cl-,故c(Cl-)
),带入数据发现,溶液中至少还有0.04mol的Cl-,故c(Cl-)![]() 0.4mol/L。
0.4mol/L。
A.由于Al3+在过量的氢氧化钠中生成沉淀全部溶解,故不一定存在Al3+,故A错误;
B.Cl-一定存在,且c(Cl-)![]() 0.4mol/L,故B错误;
0.4mol/L,故B错误;
C.有溶液中含有Fe3+,故不可能有CO32-存在,故C错误;
D.原溶液中至少存在NH![]() 、Fe3+、SO
、Fe3+、SO![]() 、Cl-,还可能含有K+,故D正确;
、Cl-,还可能含有K+,故D正确;
故答案为:D。


科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是
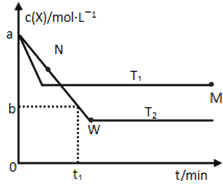
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,υ(Y)=![]() mol/(L·min)
mol/(L·min)
C.M点的正反应速率υ正大于N点的逆反应速率υ逆
D.M点时再加入一定量的X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,CO(g) + H2O (g)![]() CO2(g)+ H2(g)的平衡常数K=1。该温度下在体积均为1 L的甲、乙两个恒容密闭容器中,投入CO(g) 和 H2O (g)的起始浓度及5min时的浓度如下表所示。
CO2(g)+ H2(g)的平衡常数K=1。该温度下在体积均为1 L的甲、乙两个恒容密闭容器中,投入CO(g) 和 H2O (g)的起始浓度及5min时的浓度如下表所示。
甲 | 乙 | |||
起始浓度 | 5min时浓度 | 起始浓度 | 5min时浓度 | |
c(CO)/mol/L | 0.1 | 0.08 | 0.2 | x |
c(H2O)/mol/L | 0.1 | 0.08 | 0.2 | y |
下列判断不正确的是
A.x = y = 0.16
B.反应开始时,乙中反应速率比甲快
C.甲中0~5min的平均反应速率: v(CO)=0.004"mol/(L·min)
D.平衡时,乙中H2O的转化率是50%,c(CO)是甲中的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是( )
A.16.25gFeCl3水解形成的Fe(OH)3胶体粒子数小于0.1NA
B.22.4L(标准状况)氩气含有的分子数为0.5NA
C.标准状况下,2.24LN2和O2的混合气体中分子数为0.2NA
D.2.4gMg与H2SO4完全反应,转移的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应L(s)+aG(g)=bR(g)达到平衡时温度和压强对该反应的影响如下图所示,x轴表示温度,y轴表示平衡混合气中G的体积分数,压强P1>P2,下列判断正确的是
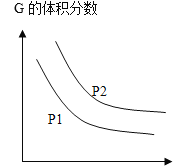
A.a>b
B.△H<0
C.当av正(G)=bv逆(R)可说明反应达到平衡状态
D.增加L的物质的量,可提高G的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是

A.恒温恒容下,再向B点体系充入N2O4,NO2的体积分数增大
B.图中A、C两点气体的颜色:A浅,C深
C.图中A、C两点气体的平均相对分子质量:A>C
D.温度T1>T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题
(1)煤的气化的主要化学反应方程式为________________
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为____________
(3)利用水煤气合成二甲醚的三步反应如下
①2H2(g)+CO(g)=CH3OH(g) △H=-90.8kJ.mo-1
②2CH3OH(g)= CH3OCH3(g)+ H2O(g) △H=-235kJ.mo-1
③CO(g)+H2O(g)=O2(g)+H2(g) △H=-413kJ.mo-1
总反应:3H2(g)+3CO(g)= CH3OCH3(g)+CO2(g)的△H=___________
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是____(填字母代号)![]()
a. 高温高压 b.加入催化剂 c.减少CO2的浓度 d.增加Co的浓度 e.分离出二甲醚
(4)已知反应②2CH3OH(g)= CH3OCH3(g)+ H2O(g)某温度下的平衡常数为400.此温度下,在2L密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
物质的量(mol) | 0.88 | 1.2 | 1.2 |
①加入的CH3OH的起始浓度为_________
②比较此时正、逆反应速率的大小:v正________v逆(填少”、“<”或“=”)
③若加入CH3OH后,经10min反应达到平衡,此时CH3OH的转化率a(CH3OH)=_________c(CH3OCH3)=____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的叙述一定不正确的是
A. 向FeCl2溶液中滴加NH4SCN溶液,溶液显红色
B. KAl(SO4) 2·12H2O溶于水可形成 Al(OH)3胶体
C. NH4Cl与Ca(OH)2混合加热可生成NH3
D. Cu与FeCl3溶液反应可生成CuCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨为重要化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a.CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+216.4kJ/mol
b.CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.2kJ/mol
则反应CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=_____________kJ/mol
(2)起始时投入氮气和氢气分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度关系如图。

①恒压时,反应一定达到平衡状态的标志是__________ (填序号);
A.N2和H2的转化率相等
B.反应体系密度保持不变
C.![]() 比值保持不变
比值保持不变
D.![]() =2
=2
②P1________P2(填“>”、“<”、“=”、“不确定”,下同);反应平衡常数:B点______D点;
③C点H2的转化率_______________;在A、B两点条件下,该反应从开始到平衡时生成氨气平均速率:v(A)_______v(B)。
(3)N2H4可作火箭推进剂,NH3和NaClO在一定条件下反应可生成N2H4。
①写出NH3和NaClO反应生成N2H4的化学方程式_____________________________________________。
②当转移电子量为0.3NA时,标况下消耗NH3____________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com