
| A. | 14 | B. | 15 | C. | 16 | D. | 17 |
科目:高中化学 来源: 题型:选择题
| A. | 16gO2与16gO3体积比为3:2 | |
| B. | 由H2、O2组成的混合气,密度是氢气的8.5倍,混合气中H2的质量分数为50% | |
| C. | 将标况下22.4L的HCl气体溶于1 L水中配制1mol/L的HCl溶液 | |
| D. | 1mL 3mol/L的K2SO4溶液和100mL 1mol/L的Al2(SO4)3溶液,SO42-浓度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 倾倒液体时试剂瓶标签面向手心. | |
| B. | 玻璃棒蘸取溶液滴到放在表面皿上湿润的pH试纸上. | |
| C. | 用HCl溶液洗涤并灼烧铂丝后,再进行焰色反应. | |
| D. | KOH溶液保存在带磨口玻璃塞的试剂瓶中. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
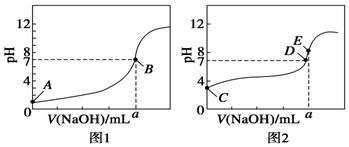 常温下,用0.100 0mol•L-1 NaOH溶液分别滴定20.00mL 0.100 0mol•L-1 HCl溶液和20.00mL 0.100 0mol•L-1 CH3COOH溶液,得到两条滴定曲线,如图所示.
常温下,用0.100 0mol•L-1 NaOH溶液分别滴定20.00mL 0.100 0mol•L-1 HCl溶液和20.00mL 0.100 0mol•L-1 CH3COOH溶液,得到两条滴定曲线,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 1L某混合溶液,可能含有的离子如表:
1L某混合溶液,可能含有的离子如表:| 可能大量含有的阳离子 | Fe3+、H+、NH4+、Al3+、K+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、ClO-、AlO2- |
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在25℃下,稀释HA、HB两种酸溶液,溶液pH变化的曲线如图所示,其中V1表示稀释前酸的体积,V2表示稀释后溶液的体积.下列说法正确的是( )
在25℃下,稀释HA、HB两种酸溶液,溶液pH变化的曲线如图所示,其中V1表示稀释前酸的体积,V2表示稀释后溶液的体积.下列说法正确的是( )| A. | lg$\frac{{V}_{2}}{{V}_{1}}$=6时,HA溶液的pH=8 | |
| B. | pH相同时,c(HA)>c(HB) | |
| C. | 曲线上a、b两点 $\frac{[{B}^{-}]}{[HB][O{H}^{-}]}$ 一定不相等 | |
| D. | 25℃时,NaA溶液的pH一定小于NaB溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15% | B. | 21% | C. | 25% | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
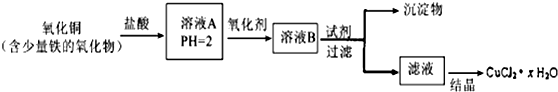
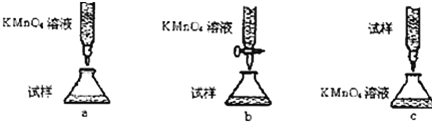
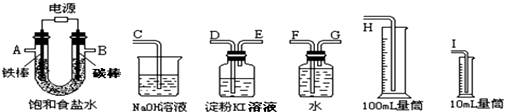
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4:5 | B. | 5:4 | C. | 2:7 | D. | 2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com