
| A. | Fe(OH)3;Fe2O3 | B. | Fe(OH)2;FeO | ||
| C. | Fe(OH)3Fe(OH)2;Fe2O3 | D. | Fe2O3;Fe(OH)3 |
分析 把少量废铁屑溶于过量的稀硫酸生成硫酸亚铁,过滤,除去杂质,在滤液中加入适量硝酸,再加入过量的氨水,有红褐色沉淀生成为Fe(OH)3,Fe(OH)3不稳定,在加热时分解生成红棕色的Fe2O3,以此来解答.
解答 解:该反应过程有关转化关系为Fe$\stackrel{H_{2}SO_{4}}{→}$Fe2+$\stackrel{HNO_{3}}{→}$Fe3+$\stackrel{氨水}{→}$Fe(OH)3$\stackrel{△}{→}$Fe2O3,有关反应为:Fe+H2SO4=FeSO4+H2↑;3Fe2++4H++NO3-═3Fe3++NO↑+2H2O;Fe3++3NH3•H2O=Fe (OH)3↓+3 NH4+;2Fe(OH)3 $\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O;因Fe(OH)2为白色沉淀,FeO和Fe3O4都为黑色物质,所以红褐色沉淀生成为Fe(OH)3,Fe(OH)3不稳定,在加热时分解生成红棕色的Fe2O3,
故选A.
点评 本题考查铁及化合物的性质,为高频考点,把握发生的反应及现象为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
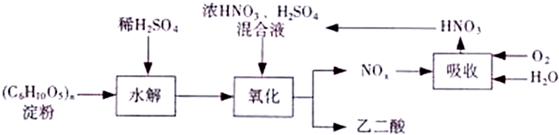
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸、亚硫酸和次氯酸都是见光易分解的挥发性酸 | |
| B. | 合金属于金属单质,很多性能与组成它的纯金属不同 | |
| C. | 金属及其氧化物、氢氧化物都不可能与强碱溶液反应 | |
| D. | 元素的非金属性、金属性强弱与其得失电子数目无直接关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 除杂试剂 | 分离方法 |
| A | NaCl溶液(CuCl2) | 钠 | 结晶 |
| B | S02(SO3) | NaOH溶液 | 萃取 |
| C | Cu(NO3)2溶液(AgNO3) | 铜粉 | 分液 |
| D | 乙醇(水) | … | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4 | B. | KAl(SO4)2 12H2O | C. | C2H5OH | D. | Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 厕所清洁剂、厨房清洁剂、醋、肥皂 | B. | 醋、厕所清洁剂、肥皂、厨房清洁剂 | ||
| C. | 厕所清洁剂、醋、肥皂、厨房清洁剂 | D. | 厨房清洁剂、醋、肥皂、厕所清洁剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 95℃纯水的pH<7,说明加热可导致水呈酸性 | |
| B. | pH=3的醋酸溶液稀释至10倍后pH=4 | |
| C. | 0.2 mol/L的盐酸与0.1 mol/L的盐酸等体积水混合后pH=1.5 | |
| D. | pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0的溶液中:Fe3+、Mg2+、Cl-、SO42- | |
| B. | 在含大量Al3+的溶液中:Na+、K+、AlO2-、NO3- | |
| C. | 滴入甲基橙指示剂呈红色的溶液中:Na+、NH4+、CO32-、NO3- | |
| D. | 水电离出的c(H+)=1×10-13mol•L-1的溶液中:K+、HCO3-、Cl-、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数. |
| Y | 原子核外的L层有3个未成对电子. |
| Z | 在元素周期表的各元素中电负性仅小于氟. |
| Q | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子. |
| R | 核电荷数是Y与Q的核电荷数之和 |
| E | 原子序数比R大3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com