
| A. | Cl2 | B. | Cl- | C. | H+ | D. | Fe3+ |
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 装 置 | 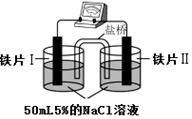 | 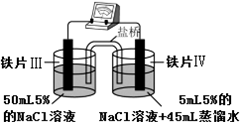 |
| 现象 | 电流计指针未发生偏转 | 电流计指针发生偏转 |
| A. | “电流计指针未发生偏转”,说明铁片Ⅰ、铁片Ⅱ均未被腐蚀 | |
| B. | 铁片Ⅳ的电极反应式可能为Fe-3e-=Fe3+ | |
| C. | 用K3Fe(CN)6]溶液检验铁片Ⅲ、Ⅳ附近溶液,可判断装置的正、负极 | |
| D. | 铁片Ⅰ、Ⅲ所处的电解质溶液浓度相同,所以二者的腐蚀速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋除去暖水瓶中的薄层水垢 | |
| B. | 一般不用纯碱代替小苏打作食品发酵粉 | |
| C. | 用甲醛溶液浸泡海产品以保鲜 | |
| D. | 用灼烧并闻气味的方法区别纯棉织物和纯毛织物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.03mol•L-1的蔗糖溶液 | B. | 0.03mol•L-1的BaCl2溶液 | ||
| C. | 0.04mol•L-1的NaCl溶液 | D. | 0.02mol•L-1的CH3COOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
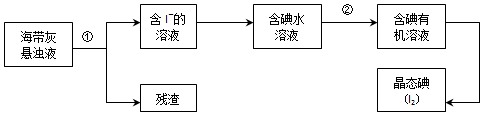
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
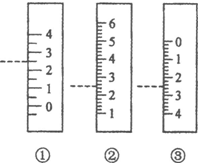 以下是我校化学兴趣小组的同学测定厨房食醋中醋酸浓度的实验,请你参与并完成相关实验:
以下是我校化学兴趣小组的同学测定厨房食醋中醋酸浓度的实验,请你参与并完成相关实验:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
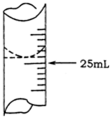 欲测定某NaOH溶液的物质的量浓度,可用物质的量浓度为0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:
欲测定某NaOH溶液的物质的量浓度,可用物质的量浓度为0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:| 实验序号 | 待测NaOH溶液的体积/mL | HCl标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 20.10 |
| 2 | 25.00 | 1.50 | 21.40 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com