
 硫及其化合物具有广泛的用途.回答下列问题:
硫及其化合物具有广泛的用途.回答下列问题:分析 (1)Se原子核外电子数为34,根据能量最低原理书写核外电子排布式;S原子3s轨道的1个电子激发到3p轨道;
(2)根据化合价代数和为0计算Co的化合价;配离子与外界离子之间形成配位键,钴离子与氨气分子等之间形成配位键,氨气分子中、硫酸根离子中含有共价键;在该配合物水溶液中,滴加BaCl2溶液,有白色沉淀,而另取配合物溶液滴加硝酸酸化的AgNO3溶液,则无沉淀生成,说明硫酸根离子为外界,氯离子为配体,配体原子含有孤对电子;
(3)硫代乙酰胺(CH3CSNH2)的结构简式为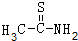 ,甲基中C原子形成4个σ键、另外C原子形成3个σ键,均没有孤对电子,杂化轨道数目分别为4、3;
,甲基中C原子形成4个σ键、另外C原子形成3个σ键,均没有孤对电子,杂化轨道数目分别为4、3;
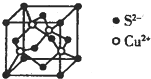
(4)根据均摊法计算晶胞中Cu、S原子数目,表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算晶体密度;Cu2+与周围的4个S2-形成正四面体结构,之间的距离最近,Cu2+与晶胞顶点的S2-连线处于晶胞体对角线上,且距离为体对角线长度的$\frac{1}{4}$,而体对角线长度为晶胞棱长的$\sqrt{3}$倍.
解答 解:(1)Se原子核外电子数为34,核外电子排布式为1s22s22p63s23p63d104s22p4;若ls22s22p63s13p5是S原子的核外电子排布式,出现这种排布现象的原因是:S原子3s轨道的1个电子激发到3p轨道,
故答案为:1s22s22p63s23p63d104s22p4;S原子3s轨道的1个电子激发到3p轨道;
(2)Cl为-价,硫酸根为-2价,氨气分子为0价,故Co的化合价为+3价;配离子与外界离子之间形成配位键,钴离子与氨气分子等之间形成配位键,氨气分子中、硫酸根离子中含有共价键;在该配合物水溶液中,滴加BaCl2溶液,有白色沉淀,而另取配合物溶液滴加硝酸酸化的AgNO3溶液,则无沉淀生成,说明硫酸根离子为外界,氯离子为配体,N原子、氯原子含有孤对电子,则该配合物中配位原子是N、Cl,
故答案为:+3;离子键、共价键、配位键;N、Cl;
(3)硫代乙酰胺(CH3CSNH2)的结构简式为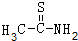 ,甲基中C原子形成4个σ键、另外C原子形成3个σ键,均没有孤对电子,杂化轨道数目分别为4、3,分别采取sp3、sp2杂化,1mol硫代乙酰胺含有8molσ键,1molπ键,
,甲基中C原子形成4个σ键、另外C原子形成3个σ键,均没有孤对电子,杂化轨道数目分别为4、3,分别采取sp3、sp2杂化,1mol硫代乙酰胺含有8molσ键,1molπ键,
故答案为:sp3、sp2;8;1;
(4)晶胞中Cu原子数目为4,Cu、S原子数目之比为1:1,故S原子数目为4,则晶胞质量为4×$\frac{96}{{N}_{A}}$g,则晶体密度=4×$\frac{96}{{N}_{A}}$g÷(a×10-10 cm)3=$\frac{384}{{N}_{A}×{a}^{3}×1{0}^{-30}}$g•cm-3,
Cu2+与周围的4个S2-形成正四面体结构,之间的距离最近,Cu2+与晶胞顶点的S2-连线处于晶胞体对角线上,且距离为体对角线长度的$\frac{1}{4}$,而体对角线长度为晶胞棱长的$\sqrt{3}$倍,则最近的Cu2+与S2-间的距离为 $\frac{\sqrt{3}}{4}$a pm,
故答案为:$\frac{384}{{N}_{A}×{a}^{3}×1{0}^{-30}}$;$\frac{\sqrt{3}}{4}$a.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、配合物、杂化方式、化学键、晶胞计算等,(4)中距离的计算为易错点、难点,需要学生具备一定的数学计算能力.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 12gC与16gO2所具有的总能量一定高于28gCO所具有的能量 | |
| B. | 56gCO所具有的能量大于88gCO2所具有的总能量 | |
| C. | 12gC和32gO2所具有的总能量大于44gCO2所具有的总能量 | |
| D. | 将一定质量的碳燃烧,生成CO2比生成CO时放出的热量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 单质沸点高低顺序为:W<X<Y<Z | |
| B. | 原子半径大小顺序为:W<X<Y<Z | |
| C. | 元素的非金属性强弱顺序为:W<X<Y<Z | |
| D. | 四种元素可以共存于一种离子化合物中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液呈中性,可选用甲基橙或酚酞作指示剂 | |
| B. | 溶液呈中性,只能选用石蕊作指示剂 | |
| C. | 溶液呈碱性,可选用甲基橙或酚酞作指示剂 | |
| D. | 溶液呈碱性,只能选用酚酞作指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
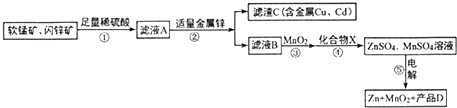
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4+4CO=3Fe+4CO2△H=-14kJ•mol-1 | |
| B. | Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)△H=-22kJ•mol-1 | |
| C. | Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)△H=+14kJ•mol-1 | |
| D. | Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)△H=-14kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com