
一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图。下列叙述中正确的是( )
A 反应的化学方程式为5YX
B t1时,Y的浓度是X浓度的1.5倍
C t2时,正、逆反应速率相等
D t3时,逆反应速率大于正反应速率
科目:高中化学 来源:广东省广州市白云中学2011届高三第二次月考化学试题 题型:022
| |||||||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源:2012-2013学年辽宁省五校协作体高三第二次联合模拟考试理综化学试卷(解析版) 题型:填空题
碘及其化合物在生产、生活中具有广泛的用途。解答下列与碘元素有关的试题:
(1)碘是人体中的微量元素之一,是一种智力元素。国家推广“加碘食盐”,其中一般加入的是KIO3,而不是KI。其原因是 。
(2)常温下,NH4I是一种固体,一定温度下在密闭容器中发生下面的反应:
① NH4I(s)
 NH3(g)
+ HI(g)
NH3(g)
+ HI(g)
② 2HI(g)  H2(g)
+ I2(g)
H2(g)
+ I2(g)
达到平衡时,缩小容器体积,增大体系压强,混合气体的颜色 (填“加深”或“变浅”或“不变”);达到平衡时,反应②的化学平衡常数表达式为 ;达到平衡时c(H2)=0.5mol/L,反应①的化学平衡常数为20,则 c (HI) = 。
(3)如图,在粗试管中加入饱和的KI溶液,然后再加入苯,插入两根石墨电极,接通直流电源。连接电源负极的电极为 极,电极反应式为 。通电一段时间后,断开电源,振荡试管,上层溶液为 色。

(4)已知Ksp(PbI2)=7.1×10-9mol3/L3。在盛有澄清的PbI2饱和溶液的试管中,滴加浓度为0.1mol/L的碘化钾溶液,振荡,可以观察到溶液中有黄色浑浊产生,这些黄色浑浊的成分是 。
查看答案和解析>>
科目:高中化学 来源:2013届浙江省高二下学期期中考试化学试卷(解析版) 题型:选择题
一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图。下列叙述中正确的是
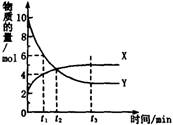
A 反应的化学方程式为5Y X
X
B t1时,Y的浓度是X浓度的1.5倍
C t2时,正、逆反应速率相等
D t3时,逆反应速率大于正反应速率
查看答案和解析>>
科目:高中化学 来源:2014届江西省等四校高一下学期联考化学试卷(解析版) 题型:选择题
一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图。下列叙述中正确的是( )

A 反应的化学方程式为5Y X
X
B t1时,Y的浓度是X浓度的1.5倍
C t2时,正、逆反应速率相等
D t3时,逆反应速率大于正反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com