
| A. | 如果V1=V2,c1=c2,则混合溶液中c(CH3COO-)=c(Na+) | |
| B. | 如果混合溶液的pH=7,则混合溶液中c(CH3COO-)=c(Na+) | |
| C. | 如果混合溶液的pH>7,则不可能V1c1=V2c2 | |
| D. | 如果V1=V2,且混合溶液的pH<7,则c1>c2 |
分析 A.根据等体积等浓度混合时醋酸与氢氧化钠恰好完全反应,则溶液中的溶质只有醋酸钠,由醋酸根离子的水解来分析;
B.由pH=7,可知c(OH-)=c(H+),再利用电荷守恒来分析;
C.混合溶液的pH>7,利用溶液中的溶质来分析;
D.根据体积相等时若混合溶液的pH<7,则溶液显酸性,应保证酸过量来分析.
解答 解:A.V1=V2,c1=c2,则醋酸与氢氧化钠恰好完全反应,反应后溶液中的溶质只有醋酸钠,由醋酸根离子的水解则c(Na+)>c(CH3COO-),故A错误;
B.pH=7,则c(OH-)=c(H+),由电荷守恒c(OH-)+c(CH3COO-)=c(Na+)+c(H+)可知,c(CH3COO-)=c(Na+),故B正确;
C.混合溶液的pH>7,溶液中的溶质可能为醋酸钠或醋酸钠与氢氧化钠的混合物,若为醋酸钠,则V1c1=V2c2,故C错误;
D.V1=V2,且混合溶液的pH<7,则溶液显酸性,溶液中的溶质为醋酸和醋酸钠,则c1>c2,故D正确;
故选AC.
点评 本题考查酸碱混合溶液的定性分析和离子的浓度关系,题目难度中等,明确酸碱混合后溶液中的溶质存在三种可能的情况是解答的关键,并注意利用弱电解质的电离和盐的水解来解答.


科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{8}^{16}$O和${\;}_{8}^{18}$O的质子数相同 | |
| B. | ${\;}_{8}^{16}$O2和${\;}_{8}^{18}$O2互为同素异形体 | |
| C. | ${\;}_{8}^{16}$O和${\;}_{8}^{18}$O中子数相差2 | |
| D. | ${\;}_{8}^{17}$O原子核内中子数与核外电子数之差为1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
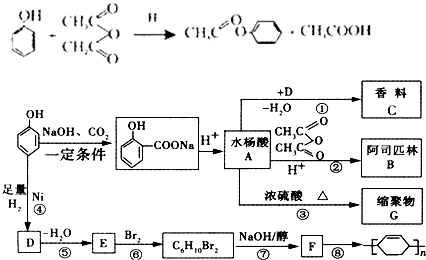
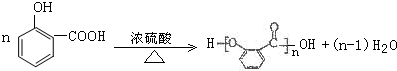 .
.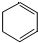 ;
;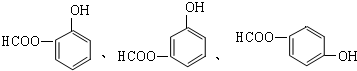 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
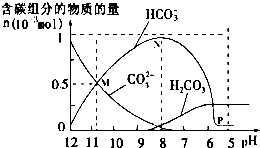 25℃时在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )
25℃时在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )| A. | HCl溶液滴加一半时,溶液pH>7 | |
| B. | 当溶液的pH=8时,溶液中NaHCO3的物质的量浓度为0.1mol•L-1 | |
| C. | 0.1 mol•L-1Na2CO3溶液中c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-) | |
| D. | 在M点:c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用陶瓷坩埚熔化氢氧化钠固体 | |
| B. | 用碱式滴定管准确量取15.00mLKMnO4溶液 | |
| C. | 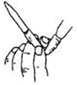 用如图所示操作排除碱式滴定管中的气泡 | |
| D. | 用苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
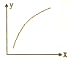 MgO可以通过下列反应制备:MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g)△H>0,该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
MgO可以通过下列反应制备:MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g)△H>0,该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( ) | 选项 | x | y |
| A | CO的物质的量 | CO与CO的物质的量之比 |
| B | SO的浓度 | 平衡常数K |
| C | 温度 | 容器内混合气体的密度 |
| D | CO的浓度 | CO的转化率 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 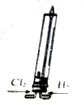 该装置可模拟工业制取氯化氢 | |
| B. | 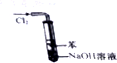 如图实验装置可以处理Cl2尾气,并防止倒吸 | |
| C. |  如图实验制取少量的Fe(OH)3胶体 | |
| D. | 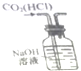 如图实验装置可除去CO2气体中含有的少量HCl杂质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com