
 某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g)?2C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如图所示.
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g)?2C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如图所示.分析 (1)0~20min内,A的浓度变化量为2mol/L-1mol/L=1mol/L,根据v=$\frac{△c}{△t}$计算v(A);
8min后,A的浓度继续减小,C的浓度继续增大,反应向正反应进行;
(2)由图象可知,30min时只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,故反应前后气体的体积不变,据此计算x的值;
(3)由(2)中分析可知,两阶段温度相同,温度相同,平衡常数相等.
解答 解:(1)0~20min内,A的浓度变化量为2mol/L-1mol/L=1mol/L,故v(A)=$\frac{1mol/L}{20min}$=0.05mol/(L•min);
8min后,A的浓度继续减小,C的浓度继续增大,反应向正反应进行,故v(正)>v(逆),
故答案为:0.05;>;
(2)由图象可知,30min时只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,故反应前后气体的体积不变,则x+1=2,故x=1,
故答案为:1;降低了压强;
(3)由(2)中分析可知,两阶段温度相同,温度相同,平衡常数相等,
故答案为:=.
点评 本题考查化学平衡图象问题,题目难度中等,本题注意根据图象浓度的变化以及影响化学反应速率的条件,本题易错,答题时注意思考.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
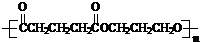 )是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景.PPG的一种合成路线如下:
)是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景.PPG的一种合成路线如下: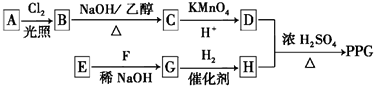
 .
.
 .
. .
. .
.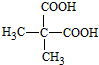 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消耗硝酸的物质的量:前者少,后者多 | |
| B. | 反应中转移的电子总数:两者相同 | |
| C. | 反应速率:两者相同 | |
| D. | 反应生成气体的颜色:前者浅,后者深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
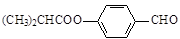 .合成M的一种途径如下:
.合成M的一种途径如下: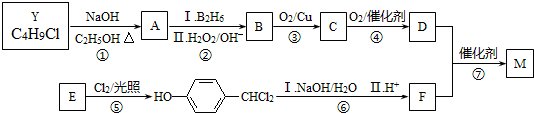
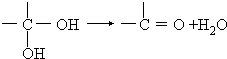
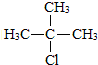 ,D的官能团名为羧基.
,D的官能团名为羧基.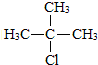 +NaOH$→_{△}^{醇}$(CH3)2C=CH2↑+NaCl+H2O.
+NaOH$→_{△}^{醇}$(CH3)2C=CH2↑+NaCl+H2O.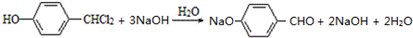 .
.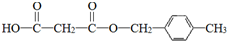 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
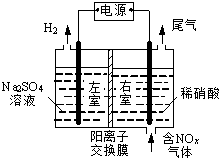 电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益.实验室模拟电解法吸收NOx的装置如右图所示(图中电极均为石墨电极).
电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益.实验室模拟电解法吸收NOx的装置如右图所示(图中电极均为石墨电极).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
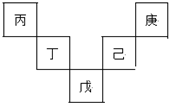 已知丙~庚元素在周期表(前四周期)中的相对位置如下图,其中己的最高氧化物对应水化物有强脱水性,丁原子最外层电子数是最内层电子数的2倍.下列判断错误的是( )
已知丙~庚元素在周期表(前四周期)中的相对位置如下图,其中己的最高氧化物对应水化物有强脱水性,丁原子最外层电子数是最内层电子数的2倍.下列判断错误的是( )| A. | 丙与戊的原子序数相差28 | |
| B. | 常温下,庚的单质能与水反应产生气体 | |
| C. | 气态氢化物的稳定性:庚<己<戊 | |
| D. | 丁的最高价氧化物可用于制造光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH2Cl | B. | CH3CH2-CHCl-CH2CH3 | ||
| C. | CH3-CHCl-CH2CH2CH3 | D. | (CH3)3CCH2Cl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com