
【题目】乳酸亚铁晶体([CH3CH(OH)COO]2Fe·3H2O,Mr=288) 可由乳酸与FeCO3反应制得,它易溶于水,是一种很好的补铁剂。
Ⅰ.制备碳酸亚铁(装置如图所示)
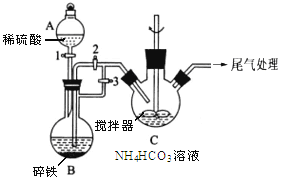
(1)仪器A的名称是______________ ;
(2)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是___________________________________________________________;然后关闭活塞1,接下来的操作是_______________; 装置C中发生反应的离子方程式为______________ 。
Ⅱ.制备乳酸亚铁
向纯净的FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应。
(3)为防止乳酸亚铁变质,在上述体系中还应加入____________________________________________________________________________
(4)为证明乳酸亚铁中含有Fe2+,选择的检验试剂为_______________________________________________________________________;
Ⅲ. 乳酸亚铁晶体纯度的测量
经过过滤、隔绝空气低温蒸发、冷却结晶、过滤、洗涤、干燥等操作,获得乳酸亚铁晶体后
(5)两位同学分别用不同的方案进行测定:
①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度,所得纯度总是大于100%,其原因可能是_________________________________________________________________________________________________________________
②乙同学经查阅文献后改用(NH4)4Ce(SO4)4滴定法测定样品中Fe2+的含量计算样品纯度(反应中Ce4+被还原为Ce3+),称取6.00g样品配成250.00mL溶液,取25mL,用0.1 molL—1(NH4)4Ce(SO4)4标准溶液滴定至终点,消耗标准液20.00mL。则产品中乳酸亚铁晶体的纯度为_______________________________________。
【答案】分液漏斗 排尽装置内的空气,防止亚铁被氧化 关闭活塞3,打开活塞2; Fe2++2HCO3=FeCO3↓+CO2↑+H2O 适量铁粉 KSCN溶液与新制氯水或铁氰化钾溶液 乳酸根中羟基被酸性高锰酸钾溶液氧化,导致消耗酸性高锰酸钾溶液的量偏多 96%
【解析】
(1)基本的实验仪器,答案为分液漏斗;
(2)碎铁中加入稀硫酸,生成氢气,排尽装置中的空气,可以防止生成的Fe2+被氧气氧化,排除空气后,在C中生成FeCO3,需要将B中的压强增大,使B中生成的Fe2+通过导管压到C装置中,操作为关闭活塞3,打开活塞2;在C中生成FeCO3,原料为Fe2+和HCO3-,根据电荷守恒可以写出方程式。答案为排尽装置内的空气,防止亚铁被氧化 关闭活塞3,打开活塞2 Fe2++2HCO3=FeCO3↓+CO2↑+H2O;
(3)Fe2+容易被氧气氧化,可以加入铁粉,使生成的Fe3+和Fe反应生成Fe2+,答案为适量铁粉;
(4)检验Fe2+可以使用铁氰化钾,或者先加KSCN溶液不变色、用加氯水将可能存在的Fe2+氧化成Fe3+再观察是否有血红色出现。答案为KSCN溶液与新制氯水或铁氰化钾溶液;
(5)①乳酸中羟基也能和酸性高锰酸钾溶液反应,消耗的高锰酸钾变多,所以纯度超过100%。②Ce4+被还原为Ce3+,Fe2+化合价升高生成Fe3+,化合价升降守恒,物质的量比例为1:1,![]() ,
,![]() ,250mL溶液取25mL,则原样品中有Fe2+ 0.02mol,[CH3CH(OH)COO]2Fe·3H2O的质量m=Mr×n=288×0.02g=5.76g,
,250mL溶液取25mL,则原样品中有Fe2+ 0.02mol,[CH3CH(OH)COO]2Fe·3H2O的质量m=Mr×n=288×0.02g=5.76g,![]() ,答案为乳酸根中羟基被酸性高锰酸钾溶液氧化,导致消耗酸性高锰酸钾溶液的量偏多 96%。
,答案为乳酸根中羟基被酸性高锰酸钾溶液氧化,导致消耗酸性高锰酸钾溶液的量偏多 96%。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】依据原电池原理,回答下列问题:

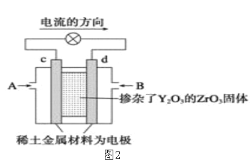
(1)图1是依据氧化还原反应:Cu(s)+2Fe3+(aq)=Cu2+(aq)+2Fe2+(aq)设计的原电池装置。
①电极X的材料是________(填化学名称);电极Y的材料是__________(填化学名称)。
②Y电极发生的电极反应式为:______________。
(2)图2是使用固体电解质的燃料电池,装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导正极生成的O2-离子(O2+4e―→2O2-)。
①c电极为______________极。(填“正”或“负”)
②d电极上的电极反应式为___________________________。
③如果消耗甲烷160g,假设化学能完全转化为电能,则转移电子的数目为______________(用NA表示),需要消耗标准状况下氧气的体积为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)质量数为37的氯原子符号为_______。
(2)S2-的结构示意图为______。
(3)氮原子的电子式为______,N2的电子式为______,NH4+的电子式为_________
(4)磷原子的核外电子排布式为______,其价电子排布式为_____,其价电子排布图为_____。
(5)含有半满p轨道的最轻原子的核外电子排布式为_______,元素名称为_______;
(6)最活泼的非金属元素原子的核外电子排布式为_______,元素名称为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应可视为旧键的断裂和新键的形成过程。化学键的键能是形成化学键时释放的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P:198P—O:360O=O:498,则反应P4(白磷)+3O2=P4O6的反应热ΔH为 ( )

A. -1638 kJ·mol-1B. +1638 kJ·mol-1C. -126 kJ·mol-1D. +126 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向 100 mL0.01 mol·L-1HA 溶液中逐滴加入0.02 mol·L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。下列叙述一定正确的是
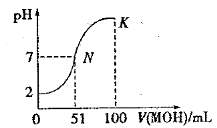
A.由图中信息可知HA为弱酸
B.在N点pH=7,酸碱恰好完全反应
C.常温时一定浓度的MA稀溶液显中性
D.K 点对应的溶液中,c(M+) + c(MOH)=2c (A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示。

下列说法不正确的是
A. 异戊二烯所有碳原子可能共平面
B. 可用溴水鉴别M和对二甲苯
C. 对二甲苯的一氯代物有2种
D. M的某种同分异构体含有苯环且能与钠反应放出氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种新型锂电池装置,电池充、放电反应为![]()
![]()
![]() 。放电时,需先引发铁和氯酸钾反 应使共晶盐熔化。下列说法不正确的是
。放电时,需先引发铁和氯酸钾反 应使共晶盐熔化。下列说法不正确的是
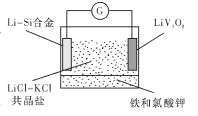
A. 共晶盐储热效果好,利于电解质熔化
B. 整个过程的能量转化只涉及化学能转化为电能
C. 放电时LiV3O8电极的反应为xLi++xe-+LiV3O8= Li1+XV3O8
D. 充电时 Cl-移向LiV3O8电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示式错误的是( )
A.Mg2+的电子排布图: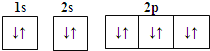
B.Na+的结构示意图:![]()
C.Cr的价层电子排布式:3d54s1
D.C的电子排布式:1s22s12p3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生反应2HI(g)+Cl2(g)![]() 2HCl(g) + I2(s)。下列事实不能说明该反应到平衡状态的是( )
2HCl(g) + I2(s)。下列事实不能说明该反应到平衡状态的是( )
A. 断裂1 mol Cl-Cl键同时形成1 mol H-Cl键 B. 容器内气体密度不再改变
C. 容器内气体压强不再改变 D. 容器内气体颜色不再改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com