
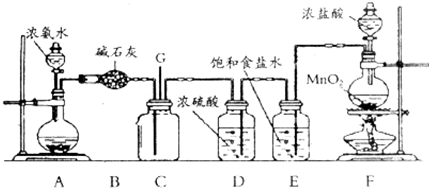
分析 (1)二氧化锰与浓盐酸反应生成氯气、氯化锰和水,依据反应中氯化氢中元素化合价变化判断盐酸表现的性质;
(2)浓盐酸易挥发,该实验中制得的氯气中含有氯化氢杂质,应除去;
(3)由题意可知发生反应为氨气和氯气生成氯化铵和氮气,依据原子个数、得失电子守恒写成反应方程式.
解答 解:(1)装置F中二氧化锰与浓盐酸加热生成氯气,方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,反应中有4mol氯化氢参加反应,只有2mol氯离子中的氯化合价升高,所以浓盐酸在反应中既表现还原性,又表现酸性;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)浓盐酸易挥发,该实验中制得的氯气中含有氯化氢杂质,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,所以可以用E除去;
故答案为:吸收氯气中的氯化氢;
(3)氨气和氯气反应生成白烟氯化铵和空气的主要成分之一氮气,即8NH3+3Cl2═6NH4Cl+N2;
故答案为:8NH3+3Cl2═6NH4Cl+N2.
点评 本题考查了氨气和氯气的制备及性质的检验,熟悉制备原理及二者化学性质是解题关键,题目难度不大.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| 盐 | 熔点(℃) | 熔化吸热(kJ•mol-1) | 参考价格(元•t-1) |
| CaCl2•6H2O | 29.9 | 37.3 | 780~850 |
| Na2SO4•10H2O | 32.4 | 77.0 | 800~900 |
| Na2HPO4•12H2O | 35.1 | 100.1 | 1 600~2 000 |
| Na2S2O3•5H2O | 45.0 | 49.7 | 1 400~1 800 |
| A. | CaCl2•6H2O | B. | Na2SO4•10H2O | C. | Na2HPO4•12H2O | D. | Na2S2O3•5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
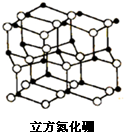 氮化硼是由氮原子和硼原子所构成的晶体,其组成为43.6%的硼和56.4%的氮(质量分数),有多种不同的变体,立方氮化硼是其中一种.立方氮化硼的硬度仅次于金刚石而远远高于其它材料,常用作磨料和刀具材料,其结构与金刚石类似(如图).
氮化硼是由氮原子和硼原子所构成的晶体,其组成为43.6%的硼和56.4%的氮(质量分数),有多种不同的变体,立方氮化硼是其中一种.立方氮化硼的硬度仅次于金刚石而远远高于其它材料,常用作磨料和刀具材料,其结构与金刚石类似(如图).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
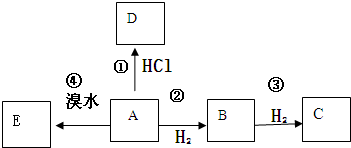
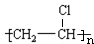 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com