
| A. | 从开始到平衡A的平均反应速率为0.3mol/(Ls) | |
| B. | 从开始到平衡B的转化率为60% | |
| C. | 此反应的化学平衡常数表达式K=$\frac{c(C)•{c}^{2}(D)}{{c}^{3}(A)•c(B)}$ | |
| D. | 若混合气体的密度不再改变时,该反应一定达到平衡状态 |
分析 2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L,生成C为0.2mol/L×2L=0.4mol,则$\frac{0.4mol}{0.8mol}$=$\frac{x}{2}$,解得x=1,则
3A(g)+B(g)?C(g)+2D(s)
开始 3 1 0 0
转化 1.2 0.4 0.4 0.8
平衡 1.8 0.6 0.4 0.8
结合v=$\frac{△c}{△t}$、转化率=$\frac{转化的量}{开始的量}$×100%及K为生成物浓度幂之积与反应物浓度幂之积的比计算.
解答 解:2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L,生成C为0.2mol/L×2L=0.4mol,则$\frac{0.4mol}{0.8mol}$=$\frac{x}{2}$,解得x=1,则
3A(g)+B(g)?C(g)+2D(s)
开始 3 1 0 0
转化 1.2 0.4 0.4 0.8
平衡 1.8 0.6 0.4 0.8
A.从开始到平衡A的平均反应速率为$\frac{\frac{1.2mol}{2L}}{2min}$=0.3mol/(L.min),故A错误;
B.从开始到平衡B的转化率为$\frac{0.4mol}{1mol}$×100%=40%,故B错误;
C.D为固体,此反应的化学平衡常数表达式K=$\frac{c(C)}{{c}^{3}(A)•c(B)}$,故C错误;
D.D为固体,混合气体的质量为变量,由ρ=$\frac{m}{V}$可知,密度为变量,则若混合气体的密度不再改变时,该反应一定达到平衡状态,故D正确;
故选D.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、K的表达式为解答的关键,侧重分析与计算能力的考查,注意固体不能列入K的表达式中及x的确定方法,题目难度不大.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:C>A | |
| B. | 离子半径:D3+>B2- | |
| C. | 非金属性:A>B | |
| D. | 最高价氧化物对应水化物的碱性:C<D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 已 知 | 类 推 | |
| A | 将铁粉投入稀硫酸中 Fe+H2SO4(稀)=FeSO4+H2↑ | 将铁粉投入稀硝酸中 Fe+2HNO3(稀)=Fe(NO3)2+H2↑ |
| B | 铝热法炼铁 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | 铝热法炼镁 2Al+3MgO$\frac{\underline{\;高温\;}}{\;}$3Mg+Al2O3 |
| C | 将乙烯通入溴水中 CH2=CH2+Br2→CH2BrCH2Br | 将丙烯通入溴水中 CH3CH=CH2+Br2→CH3CHBrCH2Br |
| D | 乙烯在适当条件下制聚乙烯 nCH2=CH2 $→_{加热、加压}^{催化剂}$ 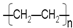 | 丙烯在适当条件下制聚丙烯 nCH3CH=CH2 $→_{加热、加压}^{催化剂}$  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用双氧水代替高锰酸钾制氧气 | |
| B. | 用多量的氯气进行性质实验 | |
| C. | 用溴水代替碘水进行萃取实验 | |
| D. | 用铜粉代替铜丝进行铜和浓硝酸的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
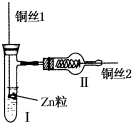 如图为氢气还原氧化铜的微型快速实验装置.实验前先将铜丝1处理成下端弯曲的小圆环,并用铁锤击成带小孔的小匙,将铜丝2一端弯曲成螺旋状.试回答下列问题:
如图为氢气还原氧化铜的微型快速实验装置.实验前先将铜丝1处理成下端弯曲的小圆环,并用铁锤击成带小孔的小匙,将铜丝2一端弯曲成螺旋状.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
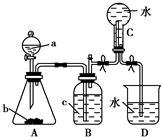 如图装置是某种气体X的制取装置和收集装置(必要时可加热).所用的试剂从下列试剂中选取2~3种:硫化亚铁、二氧化锰、铜屑、氯化铵、稀硝酸、浓盐酸、蒸馏水.请回答下列问题:
如图装置是某种气体X的制取装置和收集装置(必要时可加热).所用的试剂从下列试剂中选取2~3种:硫化亚铁、二氧化锰、铜屑、氯化铵、稀硝酸、浓盐酸、蒸馏水.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 X、Y、Z、W、R五种元素位于元素周期表前四周期,它们的原子序数依次增大
X、Y、Z、W、R五种元素位于元素周期表前四周期,它们的原子序数依次增大| 元素 | 相关信息 |
| X | 原子核外的价电子排布式为nsnnp2n |
| Y | 元素周期表中电负性最强的元素 |
| Z | Z与W位于同周期,且最外层有两个未成对电子 |
| w | 单质为淡黄色固体,能在火山口发现 |
| R | 原子的基态未成对电子致是同周期最多的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu与硝酸 | B. | 澄清的石灰水与CO2 | ||
| C. | Na与O2 | D. | AlCl3与氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.15mol/(L•min) | B. | v(B)=0.04mol/(L•s) | ||
| C. | v(C)=0.03mol/(L•s) | D. | v(D)=0.4mol/(L•min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com