
 已知A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大.A的质子数、电子层数、最外层电子数均相等,B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,D的基态原子核外成对电子数是成单电子数的3倍,E是第四周期d区原子序数最大的元素,F+的最外层电子排布全充满.请回答下列问题:
已知A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大.A的质子数、电子层数、最外层电子数均相等,B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,D的基态原子核外成对电子数是成单电子数的3倍,E是第四周期d区原子序数最大的元素,F+的最外层电子排布全充满.请回答下列问题:分析 A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大.
A的质子数、电子层数、最外层电子数均相等,则A为H元素;
B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,电子排布为1s22s22p2,则B为C元素;
D的基态原子核外成对电子数是成单电子数的3倍,则D为O元素,故C为N元素;
E4+与氩原子的核外电子排布相同,则E为Ti元素;
F是第四周期d区原子序数最大的元素,则F为Ni元素,据此解答.
解答 解:A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大.
A的质子数、电子层数、最外层电子数均相等,则A为H元素;
B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,电子排布为1s22s22p2,则B为C元素;
D的基态原子核外成对电子数是成单电子数的3倍,则D为O元素,故C为N元素;
E4+与氩原子的核外电子排布相同,则E为Ti元素;
F是第四周期d区原子序数最大的元素,则F为Ni元素,
(1)E为22号元素Ti,其价层电子排布式为3d84s2,故答案为:3d84s2;
(2)同周期元素从左到右电负性逐渐增大,电负性由大到小的顺序为H<C<N<O,故答案为:H<C<N<O;
(3)Ni(CO)4熔沸点较低,为分子晶体;Ni为过渡元素容易提供空轨道,而CO提供孤对电子,二者形成配位键,故答案为:分子晶体;配位键;
(4)①与CO32-互为等电子体的分子为BF3,故答案为:BF3;
②1mol配合物离子[Ni(NH3)4]2+,镍离子与氨分子之间有4个σ键,每个氨分子内部有3个σ键,所以1mol[Ni(NH3)4]2+中含有的σ键的数目为(4+4×3)NA 个=16NA个,故答案为:16NA;
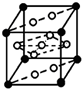
③该合金的晶胞如图所示,晶胞中心有一个镍原子,其他8个镍原子都在晶胞面上,镧原子都在晶胞顶点,所以晶胞实际含有的镍原子为1+8×$\frac{1}{2}$=5,晶胞实际含有的镧原子为8×$\frac{1}{8}$=1,所以晶体的化学式LaNi5,晶胞的密度ρ=$\frac{m}{V}$=$\frac{M}{{N}_{A}(a×1{0}^{-10}cm)^{3}}$=$\frac{M}{{N}_{A}•{a}^{3}}×1{0}^{30}$,故答案为:LaNi5; $\frac{M}{{N}_{A}•{a}^{3}}×1{0}^{30}$.
点评 本题主要考查位置、结构与性质关系的综合应用,涉及核外电子排布、等电子体、化学键、晶胞的结构等知识,题目难度中等,答题时注意观察图中晶胞的结构.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
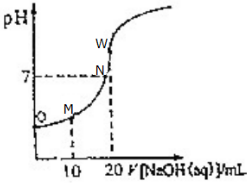
| A. | N点醋酸与NaOH恰好中和 | |
| B. | O点溶液的pH>1 | |
| C. | M点存在:2c(Na+)═c(CH3COO-)+c(CH3COOH) | |
| D. | W点溶液中水的电离程度最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
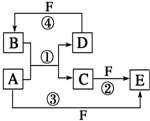 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 装置 | 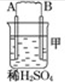 | 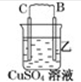 | 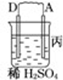 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,11.2 L N2含有的分子数为0.5 NA | |
| B. | 2.4g Mg变为Mg2+时失去的电子数目为0.2NA | |
| C. | 1 L 1mol•L-1 CH3COONa溶液中存在NA个CH3COO- | |
| D. | 1 mol Cn H2n+2含有(3n+2)NA个共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com