
【题目】测定![]() 溶液先升温再降温过程中的
溶液先升温再降温过程中的![]() ,数据如下表。实验过程中,取①、④时刻的溶液,加入盐酸酸化的
,数据如下表。实验过程中,取①、④时刻的溶液,加入盐酸酸化的![]() 溶液做对比实验,④产生白色沉淀多。下列说法不正确的是
溶液做对比实验,④产生白色沉淀多。下列说法不正确的是
时刻 | ① | ② | ③ | ④ |
温度 | 25 | 30 | 40 | 25 |
| 9.66 | 9.52 | 9.37 | 9.25 |
A. ![]() 溶液中存在水解平衡:
溶液中存在水解平衡:![]()
B. ④产生的白色沉淀是![]()
C. ①→③的过程中,![]() 在降低
在降低
D. ①→③的过程中,温度与![]() 相比,前者对水解平衡的影响更大
相比,前者对水解平衡的影响更大
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】镁是一种银白色的碱土金属,镁元素在地壳中的含量约为2.00%,位居第八位,镁及其化合物在研究和生产中具有广泛用途。请回答下列问题:
(1)氮化镁(Mg3N2)是由氮和镁所组成的无机化合物。在室温下纯净的氮化镁为黄绿色的粉末,能与水反应,常用作触媒,实验室欲用如图1所示装置和药品制备少量氮化镁。

①A中盛装的是浓氨水,B中可盛装___,二者混合可制取氨气。
②按照气流的方向从左至右连接装置:a接___、___接___、___接___。
③已知氨气有还原性,能还原氧化铜,生成物之一是空气的主要成分,该反应的化学方程式为____________________。
④如果没有装有无水氯化钙的装置,可能发生反应的化学方程式为____________________。
(2)碳酸镁可用作耐火材料、锅炉和管道的保温材料,以及食品、药品、化妆品、橡胶、墨水等的添加剂。合成碳酸镁晶须的步骤如下:
步骤1:配制0.5 mol·L-1 MgSO4溶液和0.5 mol·L-1 NH4HCO3溶液。
步骤2:用量筒量取500 mL NH4HCO3溶液于1 000 mL四口烧瓶中,开启搅拌器,温度控制在50 ℃。
步骤3:将250 mL MgSO4溶液逐滴加入NH4HCO3溶液中,1 min内滴加完毕,然后用氨水调节溶液pH到9.5。
步骤4:放置1 h后,过滤,洗涤。
步骤5:在40 ℃的真空干燥箱中干燥10 h,得到碳酸镁晶须产品(MgCO3·nH2O,n=1~5)。
①配制0.5 mol·L-1 MgSO4溶液500 mL,需要的仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、_____。
②步骤3中加氨水后反应的离子方程式为______________。
测定合成的MgCO3·nH2O中的n值。
称量1.000 g碳酸镁晶须,放入图2所示的广口瓶中,加入适量水,滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5 h,后期将温度升到30 ℃,最后烧杯中的溶液用已知浓度的盐酸滴定,测得生成CO2的总量;重复上述操作2次。
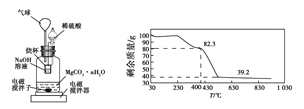
③图中气球的作用是__________________。
④上述反应后期要升温到30 ℃,主要目的是________________。
⑤若实验测得1.000 g碳酸镁晶须产生CO2的平均物质的量为a mol,则n为___(用含a的表达式表示)。
⑥称取100 g上述晶须产品进行热重分析,得到的热重曲线如图所示,则合成的晶须中n=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,书写正确的是( )
A.铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
B.稀硫酸与氢氧化钡溶液反应:Ba2++H++OH-+![]() =H2O+BaSO4↓
=H2O+BaSO4↓
C.在澄清石灰水中通入过量的CO2:Ca2++2OH-+CO2=CaCO3↓+H2O
D.铜片跟硝酸银溶液反应:Cu+2Ag+=Cu2++2Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①Na2O、Fe2O3、Al2O3属于碱性氧化物,CO2、SiO2、NO2属于酸性氧化物
②碳酸钠、氢氧化钡、氯化铝、过氧化钠都属于离子化合物
③漂白粉、水玻璃、Fe(OH)3胶体、冰水混合物均属于混合物
④醋酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物
⑤硅导电,食盐水导电均属于物理变化
⑥盐酸属于混合物,而液氯、冰醋酸均属于纯净物。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新能源汽车的核心部件是锂离子电池,常用磷酸亚铁锂(LiFePO4)做电极材料。对LiFePO4废旧电极(含杂质Al、石墨粉)回收并获得高纯Li2CO3的工业流程如图:
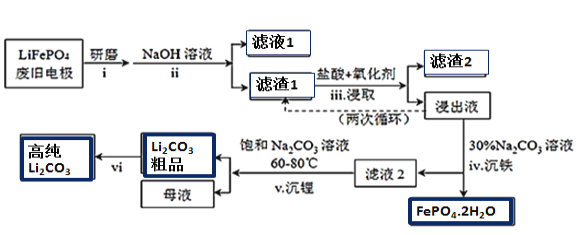
资料:碳酸锂在水中溶解度随温度变化如下:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
(1)过程i研磨粉碎的目的是__________________。
(2)过程ii加入足量NaOH溶液的作用(用化学反应方程式表示)_________________。
(3)如过程iii采用NaClO3作为氧化剂,则过程中会反应会发生副反应生成黄绿色气体,
①该副反应对应的离子方程式为_______________________________________________________;
从环保角度分析,选择___________(填字母)作为该过程的氧化剂会更好。
a.H2O2 b.浓硫酸 c.浓HNO3
②过程iii得到的浸出液循环两次的目的是________________________________________________。
(4)浸出液中存在大量H2PO4﹣和HPO42-,已知:![]() ,结合平衡移动原理,解释过程iv得到磷酸铁晶体的原因______________________________________。
,结合平衡移动原理,解释过程iv得到磷酸铁晶体的原因______________________________________。
(5)简述过程vi的操作______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有![]() 的四种溶液:①
的四种溶液:①![]() ②
②![]() ③
③![]() ④
④![]()
(1)任选上述一种酸性溶液,用化学用语解释其呈酸性的原因:__________.
(2)溶液②的![]() _____________。
_____________。
(3)溶液②、③等体积混合后,溶液中![]() ________
________![]() (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(4)溶液④加热后碱性增强,结合化学用语解释原因:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 在不同的溶剂中可形成不同的分散系:
在不同的溶剂中可形成不同的分散系:![]() 溶解在水中形成无色透明的分散系一;
溶解在水中形成无色透明的分散系一;![]() 溶解在乙醇中形成无色透明的分散系二。下列说法正确的是( )
溶解在乙醇中形成无色透明的分散系二。下列说法正确的是( )
A. 分散系二与雾、霾为同一种类型的分散系
B. 在两个分散系中,![]() 都是以
都是以![]() 和
和![]() 的形式存在
的形式存在
C. 分散系二中,分散质粒子的个数为![]() 个
个
D. 两个分散系都是电解质且性质较稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1 173 K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是_______(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
(3)根据反应①与②可推导出K1、K2与K3之间的关系式为__________,据此关系式及上表数据,能推断出反应③是________(填“吸热”或“放热”)反应。
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有______ 、_____ (填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(5)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:

①图甲中t2时刻发生改变的条件是__________。
②图乙中t2时刻发生改变的条件是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】定条件下存在反应:H2(g)+I2(g) ![]() 2HI(g) △H<0.现有三个相同的1L恒容绝热(与外界没有热量交换)态闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入lmolH2和1molⅠ2(g),在Ⅱ中充入2molHl(g).在Ⅰ中充入2molH2和2molI2 (g),700℃条件下开始反应。达到平衡时,下列说法正确的是()
2HI(g) △H<0.现有三个相同的1L恒容绝热(与外界没有热量交换)态闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入lmolH2和1molⅠ2(g),在Ⅱ中充入2molHl(g).在Ⅰ中充入2molH2和2molI2 (g),700℃条件下开始反应。达到平衡时,下列说法正确的是()
A. 容器Ⅰ、Ⅱ中反应速率相同
B. 容器Ⅰ、Ⅲ中反应的平衡常数相同
C. 容器Ⅰ中的气体颜色比容器Ⅱ中的气体颜色浅
D. 容器Ⅰ中H2的转化率与容器Ⅱ中HI的转化之和小于1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com