
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:
2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O下列说法正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O下列说法正确的是
A.KClO3在反应中失去电子 B.ClO2是氧化剂
C.H2C2O4在反应中被氧化 D.1 mol KClO3参加反应有2 mol电子转移
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】把3molP和2.5molQ置于2L密闭容器中,发生如下反应:3P(g)+Q(g)![]() x M(g)+2N(g),5min后达到平衡生成1molN,经测定M的平均速率是0.1mol/(Lmin),下列叙述不正确的是
x M(g)+2N(g),5min后达到平衡生成1molN,经测定M的平均速率是0.1mol/(Lmin),下列叙述不正确的是
A.P的平均反应速率为0.15 mol/(Lmin)
B.Q的平衡浓度为1 mol/L
C.Q的转化率为25%
D.x等于2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质间有如图所示的转化关系。已知B、D、G是常见的金属单质,E为常见的非金属单质,H常温下为无色液体,K为红棕色气体。
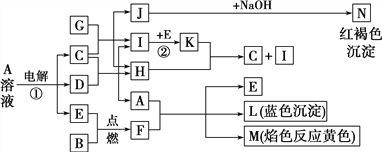
(1)F的电子式为______________,写出其与CO2反应的化学方程式并用双线桥标出电子转移的方向和数目:_________________________________
(2)反应①的离子方程式为____________________________________________。
(3)C与足量G反应的化学方程式为_____________________________________。其中,还原剂与氧化剂的物质的量之比为____________,检验反应中生成的金属离子的试剂为______________。
(4)Al能与A发生置换反应,生成物溶质与Na2CO3不能在溶液中大量共存,用离子方程式表示其原因:__________________________________
(5)I可由某种氢化物催化氧化得到,其反应的化学方程式为_______________________________。
(6)漂白粉和F都应密封保存,写出漂白粉露置于空气中失效的化学方程式:________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列问题。
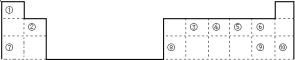
(1)写出下列序号表示的元素的符号:
①_________⑤__________⑧__________。
(2)上述10种元素中,金属元素有_____种。
(3)上述10中元素中,最不活泼的元素是________________(用元素名称表示)。
(4)⑨在周期表中的位置是___________。
(5)实验室制取④的最简单氢化物的化学反应方程式是:___________;单质⑦与水反应的离子方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把元素周期表中第16号元素和第6号元素的原子相比较,下列数据中前者是后者的4倍的是( )
A.电子数
B.最外层电子数
C.中子数
D.次外层电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗碘中通常含ICl和IBr,称为卤素互化物,其性质和卤素单质相似,都是较强的氧化剂,而且受热时ICl和IBr皆可像I2一样升华,在粗碘中加入以下选项中的一种物质后,再进行升华可制得精碘,应加入的物质是( )。
A. H2O B. Zn C. KI D. KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是部分城市某日空气质量日报:
城市 | 污染指数 | 首要污染物 | 空气质量等级 | ||
SO2 | NO2 | PM10 | |||
A | 98 | 23 | 67 | SO2 | Ⅱ |
B | 47 | 29 | 35 | SO2 | Ⅰ |
C | 62 | 80 | 113 | PM10 | Ⅲ |
D | 52 | 76 | 59 | NO2 | Ⅰ |
(1) 由上表可知,空气质量日报中涉及的污染物主要是____________和可吸入颗粒物(PM10)。
(2) 汽车尾气则是城市大气中氮氧化物的主要来源之一。治理方法之一是在汽车排气管上加装“催化转化器”,使CO与NOx反应生成可参与大气生态环境循环的无毒气体,写出反应方程式_______________________________________。
(3) SO2的排放是造成酸雨的主要因素。形成酸雨的原理之一可简单表示如下:
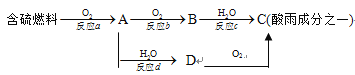
请回答下列问题:
①酸雨的pH____________(填“>”、“<”或“=”)5.6 ;
②反应b的化学方程式为____________________________________;
③在一段时间内连续不断测定溶液D的pH值,发现pH值变小,表示该变化的化学方程式是_________________。
④若用足量的氢氧化钠溶液吸收含二氧化硫的工业废气,写出该反应的离子方程式______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质及其应用的说法,正确的是
A. 碳酸钠溶液呈碱性,可用热的纯碱溶液除去矿物油污渍
B. 氧化铝的熔点很高,可用于制作耐高温材料
C. Cl2、SO2均有漂白性,可使紫色石蕊溶液褪色
D. 钠的金属性强于钾,工业上可用钠制取钾Na+KCl![]() K↑+NaCl
K↑+NaCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com