

分析 (1)NH4+是多原子构成的阳离子,电子式要加中括号和电荷;
(2)检验铵根离子,通常加入碱液加热,然后用湿润的红色石蕊试纸检验;
(3)设出二氧化氮和氧气的体积,NO2和O2按体积比5:1混合后充入一干燥烧瓶中,把烧瓶倒置于水中发生反应:4NO2+O2+2H2O=4HNO3,根据方程式计算,剩余1LNO2和水反应生成硝酸和一氧化氮,结合溶质物质的量和溶液体积计算;
解答 解:(1)NH4+是多原子构成的阳离子,电子式要加中括号和电荷,其电子式为: ,
,
故答案为: ;
;
(2)检验某固体中含有NH4+的操作方法为:取少量试样加入到试管中加水溶解,加入氢氧化钠溶液加热,在试管口用湿润的红色石蕊试纸检验放出气体,试纸由红变蓝,证明固体含铵根离子,
故答案为:取少量试样加入到试管中加水溶解,加入氢氧化钠溶液加热,在试管口用湿润的红色石蕊试纸检验放出气体,试纸由红变蓝证明固体含铵根离子;
(3)标准状况下,将体积比为5:1的NO2、O2混合气体充满烧瓶,
设混合气体中含有标准状况下5LNO2,1VLO2,二氧化氮和氧气4:1混合全部溶于水生成硝酸,则烧瓶的体积为6L,剩余二氧化氮和水反应生成一氧化氮,剩余一氧化氮为$\frac{1}{3}$L,反应后烧瓶中形成溶液,则溶液体积为(6-$\frac{1}{3}$)L,
4NO2 +O2 +2H2O=4HNO3
$\frac{4}{22.4}$mol $\frac{4}{22.4}$mol
3NO2 +H2O=2HNO3+NO
3 2
$\frac{1}{22.4}$mol $\frac{2}{3×22.4}$mol
对此烧瓶用水进行喷泉实验.烧瓶内所得溶液浓度为c(HNO3)=$\frac{\frac{4}{22.4}mol+\frac{2}{3×22.4}mol}{(6-\frac{1}{3})L}$=0.03676mol/L;
故答案为:0.0368.
点评 本题考查了电子式书写、离子检验、混合气体溶于水溶液浓度的计算,掌握基础是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 金刚石>晶体硅>二氧化硅>碳化硅 | B. | I2>Br2>Cl2>F2 | ||
| C. | H2Te>H2Se>H2S>H2O | D. | 金刚石>CsCl>NaCl>钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
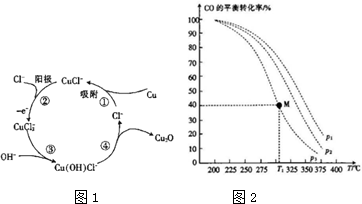
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
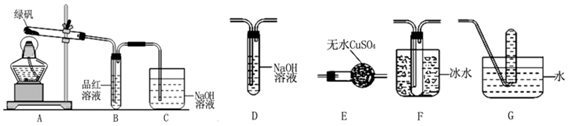
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
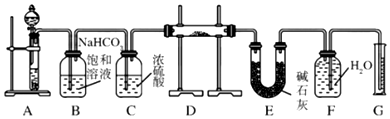
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
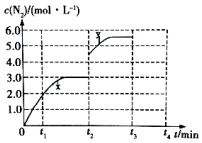 已知在298K和101kPa条件下,有如下反应:
已知在298K和101kPa条件下,有如下反应:| 物质(mol) 时间 | NO | CO | N2 | CO2 |
| 起始 | 0.40 | 1.0 | ||
| 2min 末 | 2.0 | 0.80 | 1.6 | |
| 4min 末 | 1.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
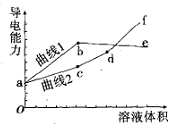 分别用浓度均为0.5mol/L的NH3•H2O和NaOH溶液,滴定20mL0.01mol/L Al2(SO4)3溶液,随滴定溶液体积的增大,溶液的导电能力变化曲线如图所示,下列说法中正确的是( )
分别用浓度均为0.5mol/L的NH3•H2O和NaOH溶液,滴定20mL0.01mol/L Al2(SO4)3溶液,随滴定溶液体积的增大,溶液的导电能力变化曲线如图所示,下列说法中正确的是( )| A. | 曲线2 代表滴加NH3•H2O溶液的变化曲线 | |
| B. | b和d点对应的溶液均显碱性 | |
| C. | b点溶液中c(NH4+ )>c(SO42- )>c(H+ )>c(OH- ) | |
| D. | df段导电能力升高的原因是发生了反应Al(OH)3+OH-═[Al(OH)4]- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

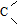 →-N=
→-N=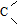 ;
;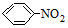 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$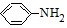 (易被氧化).请回答:
(易被氧化).请回答: ;
;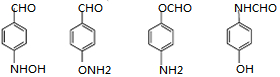 ;
;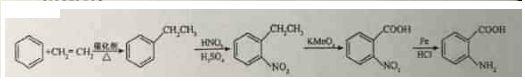 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 LCCl4中含Cl原子数目为0.4NA | |
| B. | 28g聚乙烯中所含原子数为6NA | |
| C. | 0.1mol苯乙烯中含有双键的数目为0.4NA | |
| D. | 常温常压下,10 g 46%酒精水溶液中含氧原子总数为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com