
下列能确认化学平衡发生了移动的是( )
A.化学反应速率发生改变
B.有气态物质参加的可逆反应达到平衡后,改变压强
C.由于某一条件的改变,使平衡体系中各组分的浓度发生了不同程度的改变
D.可逆反应达到平衡后,使用催化剂
科目:高中化学 来源:2014年高二化学苏教版选修2 2.3硫酸工业练习卷(解析版) 题型:填空题
下面是一种燃煤烟气脱硫方法的原理:用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4。
其中氨水吸收燃煤烟气中SO2的化学反应为:
2NH3+SO2+H2O=(NH4)2SO3;(NH4)2SO3+SO2+H2O=2NH4HSO3
能提高燃煤烟气中SO2去除率的措施有________(填字母)。
①增大氨水浓度
②升高反应温度
③使燃煤烟气与氨水充分接触
④通入空气使HSO3-转化为SO42-
A.①② B.①②③④ C.①③ D.②③④
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 1.3海水淡化练习卷(解析版) 题型:选择题
科学家预言“水短缺,不久将成为一个严重的社会危机”,这是因为( )。
A.水中蕴含着丰富的化学资源,提取这些资源消耗了水
B.温室效应,水在不断地蒸发减少
C.淡水资源不充足,且分布不均匀
D.水源不断受到污染,使淡水资源越来越不充足
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 9化学平衡常数练习卷(解析版) 题型:选择题
在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X(g)+3Y(g) 2Z(g),其平衡常数为1 600
2Z(g),其平衡常数为1 600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 8化学平衡移动练习卷(解析版) 题型:选择题
已知反应:A(g)+3B(g) 2C(g)是放热反应,达到平衡后,将气体混合物的温度降低,下列叙述中正确的是( )
2C(g)是放热反应,达到平衡后,将气体混合物的温度降低,下列叙述中正确的是( )
A.正反应速率增大,逆反应速率变小,平衡向正反应方向移动
B.正反应速率变小,逆反应速率增大,平衡向逆反应方向移动
C.正反应速率和逆反应速率都变小,平衡向正反应方向移动
D.正反应速率和逆反应速率都变小,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 7化学平衡状态的建立及标志练习卷(解析版) 题型:选择题
在一定温度下,在恒容的密闭容器中进行的可逆反应A(g)+3B(g) 2C(g)达到平衡的标志是( )
2C(g)达到平衡的标志是( )
A.C生成的速率和C分解的速率相等
B.单位时间内生成n mol A,同时生成3n mol B
C.B的消耗速率与C的消耗速率之比为1∶1
D.混合气体密度保持不变
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 6影响化学反应速率的因素练习卷(解析版) 题型:填空题
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有 ________________________________;
(2)要加快上述实验中气体产生的速率,还可采取的措施有 (答两种);
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应容器中,收集产生的气体,记录获得相同体积的气体所需时间。
实验
混合溶液 ABCDEF
4 mol·L-1 H2SO4溶液/mL30V1V2V3V4V5
饱和CuSO4溶液/mL00.52.55V620
H2O/mLV7V8V9V10100
①请完成此实验设计,其中:V1= ,V6= ,V9= ;
②反应一段时间后,实验A中的金属呈 色,实验E中的金属呈 色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因 。
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 5化学反应速率练习卷(解析版) 题型:选择题
合成氨反应N2+3H2 2NH3,某段时间内的平均反应速率分别用v(N2)、v(H2)、v(NH3)表示(单位均为mol·L-1·s-1)时,下列关系式中正确的是( )
2NH3,某段时间内的平均反应速率分别用v(N2)、v(H2)、v(NH3)表示(单位均为mol·L-1·s-1)时,下列关系式中正确的是( )
A.v(H2)=v(NH3)B.v(N2)=2v(NH3)
C.v(NH3)=v(H2)D.v(H2)=3v(N2)
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 22电解原理的应用练习卷(解析版) 题型:选择题
某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收制得有较强杀菌能力的消毒液,设计了如图所示的装置,以下对电源电极名称和消毒液的主要成分判断正确的是( )
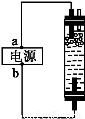
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极,b为阳极;HClO和NaCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com