
醋酸是中学常用的一种弱酸。
(1)取0.10mol CH3COOH作导电性实验,
测得其导电率随加入的水量变化如图所示:
开始时导电率为0说明: 。
② 比较a、 b点的相关性质(填“>”、“<”、“=”):
n(H+):a b;c(CH3COO-):a b;
完全中和时消耗NaOH的物质的量:a b;
③ 若b点时,溶液中c(CH3COOH)=0.10mol/L,c(H+)=1.3×10-3mol/L,则此时c(CH3COO-)约为 mol/L;计算b点时醋酸的电离平衡常数,写出计算过程 。
(2)已知:H+(aq) + OH-(aq) = H2O(l) △H1=-57.3 kJ/mol
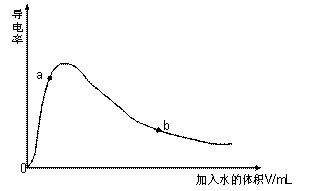
CH3COOH(aq) 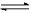 H+(aq) +CH3COO-(aq) △H2=+1.3 kJ/mol
H+(aq) +CH3COO-(aq) △H2=+1.3 kJ/mol
写出稀醋酸与稀烧碱溶液反应的热化学方程式:
。
(3)室温下,取浓度均为0.10mol/L的醋酸与醋酸钠溶液等体积混合后,测得其pH<6,写出混合溶液中的物料守恒关系式 ;并列出其中的离子浓度大小顺序(由大到小) 。
(1)①醋酸为共价化合物,只在水溶液中才能电离(2分);② <;>;=(3分,各1分);
③ 1.3×10-3 (1分);
 =( 1.3×10-3)2/0.10 mol/L=1.7×10-5 mol/L
=( 1.3×10-3)2/0.10 mol/L=1.7×10-5 mol/L
(3分,答1.69×10-5 mol/L扣1分)
(2)CH3COOH(aq)+ OH-(aq) = H2O(l) +CH3COO-(aq) △H=-56.0kJ/mol (3分)
(3)c(CH3COOH)+c(CH3COO-)=2c(Na+)或c(CH3COOH)+c(CH3COO-)=0.1mol/L;
c(CH3COO-)>c(Na+)>c(H+)>c(OH-) (4分;各2分)


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
用铁片与稀硫酸反应时,下列措施不能使反应速率加快的是
A.加热 B.滴加少量的CuSO4溶液
C.不用稀硫酸,改用98%浓硫酸 D.不用铁片,改用铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
在下述条件下,一定能大量共存的离子组是 ( )。
A.无色透明的水溶液中:K+、Ba2+、Cl-、MnO4-
B.含有大量NO3-的水溶液中:NH4+、Fe2+、SO42-、H+
C.滴入酚酞试剂显红色的溶液中:Na+、K+、CO32-、Br-
D.强碱性溶液中:ClO-、S2-、HSO3-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
我国某大型电解铜生产企业,其冶炼工艺中铜、硫回收率达到97%、87%。下图表示其冶炼加工的流程:

冶炼中的主要反应:Cu2S+O2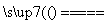 2Cu+SO2
2Cu+SO2
(1)烟气中的主要废气是________,从提高资源利用率和减排考虑,其综合利用方式是_________________________________________________________。
(2)电解法精炼铜时,阳极是________(填“纯铜板”或“粗铜板”);粗铜中含有的金、银以单质的形式沉淀在电解槽________(填“阳极”或“阴极”)的槽底,阴极的电极反应式是_______________________________________。
(3)在精炼铜的过程中,电解质溶液中c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解。
几种物质的溶度积常数(Ksp)
| 物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| Ksp | 8.0×10-16 mol3·L-3 | 4.0×10-38 mol4·L-4 | 3.0×10-17 mol3·L-3 | 2.2×10-20 mol3·L-3 |
①调节电解液的pH是除去杂质离子的常用方法。根据上表中溶度积数据判断,含有等物质的量浓度的Fe2+、Zn2+、Fe3+、Cu2+的溶液,随pH升高最先沉淀下来的离子是________。
②一种方案是先加入过量的H2O2,再调节pH到4左右,加入H2O2的目的是_________________________________________________________________。
加入H2O2后发生反应的离子方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知可逆反应CO(g)+H2O(g)  CO2(g)+H2(g) ΔH<0,反应达到平衡状态后,欲提高CO的转化率,可以采取的措施为
CO2(g)+H2(g) ΔH<0,反应达到平衡状态后,欲提高CO的转化率,可以采取的措施为
A.增大压强 B.升高温度 C.增大CO的浓度 D.分离出CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是 ( )。
A.1.0 mol·L-1的KNO3溶液中:H+、Fe2+、Cl-、SO42-
B.c(H+)<c(OH-)的溶液中:Na+、K+、SO42-、ClO-
C.能使pH试纸变红的溶液中:K+、Ba2+、AlO2-、Cl-
D.pH=0的溶液中:Mg2+、Na+、F-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
离子反应是中学化学中重要的反应类型。回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在有________(填序号)。
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)可用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下图。请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系。
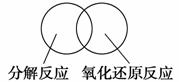
 |
(3)离子方程式是重要的化学用语。下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点。
| ①所有的离子方程式均可以表示一类反应 | |
| ②酸碱中和反应均可表示为H++OH-===H2O | |
| ③离子方程式中凡是难溶性酸、碱、盐均要标“↓”符号 |
(4)试列举出三种不同类别的物质(酸、碱、盐)之间的反应,它们对应的离子方程式都可用“Ba2++SO42-===BaSO4↓”来表示,请写出有关反 应的化学方程式(3个):
应的化学方程式(3个):
①_________________________________________ _____________________;
_____________________;
②______________________________________________________________;
③_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
最近科学家发现了氧元素的一种新的粒子O4,对于这种新粒子,下列说法不正确的
是( )
A.它是氧气的一种同素异形体 B.它是氧元素的一种同位素
C.它的摩尔质量是64 g·mol-1 D.它具有很强的氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应综合应用:氧化还原反应滴定
(1)配平氧化还原反应方程式:
C2O42-+____MnO4-+____H+===____CO2↑+_ ___Mn2++____H2O
___Mn2++____H2O
(2 )称取6.0 g含
)称取6.0 g含 H2C2O4·2H2O、KHC2O4和K2
H2C2O4·2H2O、KHC2O4和K2 SO4的试样,加水溶解,配成250 mL溶液。量取两份此溶液各25 mL,分别置于两个锥形瓶中。
SO4的试样,加水溶解,配成250 mL溶液。量取两份此溶液各25 mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25 mol·L-1 NaOH溶液至20 mL时,溶液由无色变为浅红色。该溶液被中和的H+的总物质的量为________mol。②第二份溶液中滴加0.10 mol·L-1的酸性高锰酸钾溶液。
A.KMnO4溶液在滴定过程中作________(填“氧化剂”或“还原剂”),该滴定过程________(填“需要”或“不需要”)另加指示剂。滴至16 mL时反应完全,此时溶液颜色由________变为________。
B.若在接近终点时,用少量蒸馏水将锥形瓶冲洗一下,再继续滴定至终点,则所测结果________(填“偏大”、“偏小”或“无影响”)。
C.若在达到滴定终点时俯视读数,则所得结果________(填“偏大”、“偏小”或“无影响”)。
③原试样中H2C2O4·2H2O的质量分数为________,KHC2O4的质量分数为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com