
| 试剂 | FeCl3溶液 | 酸性KMnO4溶液 | NaHCO3溶液 |
| 现象 | 溶液变紫色 | 褪色 | 放出气体 |
| A. | 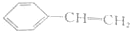 | B. | 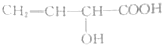 | ||
| C. | 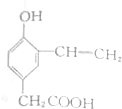 | D. | 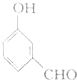 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
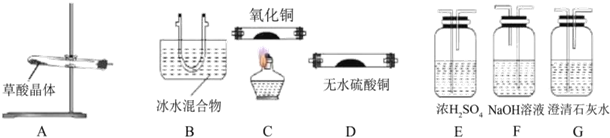
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
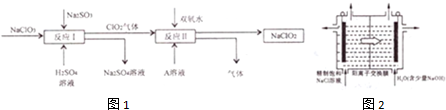
 HClO2+OH-(用离子方程式表示).
HClO2+OH-(用离子方程式表示).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
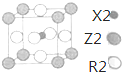 X、Y、Z、W、R是原子序数依次增大的前四周期元素(稀有气体除外).X的基态原子中的电子平均分布在三个不同的能级中;Y的族序数是其周期数的三倍;Z的基态原子核外无未成对电子;W为前四周期中电负性最小的元素;元素R位于周期表的第10列.
X、Y、Z、W、R是原子序数依次增大的前四周期元素(稀有气体除外).X的基态原子中的电子平均分布在三个不同的能级中;Y的族序数是其周期数的三倍;Z的基态原子核外无未成对电子;W为前四周期中电负性最小的元素;元素R位于周期表的第10列.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的SO2通入NaOH溶液中:SO2+2OH-═SO32-+H2O | |
| B. | Fe2O3溶于氢碘酸:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 碳酸氢铵溶液与足量氢氧化钠溶液反应:NH4++OH-═H2O+NH3↑ | |
| D. | 二氧化硫通入溴水中,溴水褪色:SO2+Br2+2H2O═4H++2Br-+SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
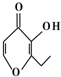 央视焦点访谈节目在2010年10月报道,俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
央视焦点访谈节目在2010年10月报道,俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )| A. | 该有机物遇FeCl3溶液显紫色 | |
| B. | 1mol该有机物最多能与3 mol H2发生加成反应 | |
| C. | 该有机物能发生取代、加成、氧化和消去反应 | |
| D. | 该有机物的一种芳香族同分异构体能发生银镜反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com