
下列反应对应的离子方程式书写正确的是 ( )。
A.漂白粉露置在空气中失效:ClO-+CO2+H2O=HClO+HCO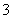
B.氢氧化钡溶液与硫酸氢钠溶液反应后溶液恰好为中性:
Ba2++H++SO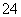 +OH-=BaSO4↓+H2O
+OH-=BaSO4↓+H2O
C.Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑
D.在强碱性溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4,
4OH-+3ClO-+2Fe(OH)3=2FeO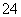 +3Cl-+5H2O
+3Cl-+5H2O
科目:高中化学 来源: 题型:
已知I2+SO32-+H2O===SO42-+2I-+2H+。某无色溶液中只可能含有I-,NH4+,Ba2+, SO32-,MnO4-中的一种或几种,若向该溶液中滴加少量的溴水,溶液仍为无色,下列判断正确的是
A.该溶液中肯定不含I- B. 该溶液中可能含有Ba2+
C. 该溶液中肯定含有NH4+ D. 该溶液中可能含有MnO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列解释实验现象的反应方程式正确的是( )
A.切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2=Na2O2
B.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色2AgCl+S2-=Ag2S↓+2Cl-
C.Na2O2在潮湿的空气中放置一段时间,变成白色黏稠物2Na2O2+2CO2=2Na2CO3+O2
D.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀2HCO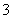 +Ca2++2OH-=CaCO3↓+CO
+Ca2++2OH-=CaCO3↓+CO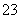 +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列分子或离子在指定的分散系中能大量共存的一组是
A.银氨溶液: Na+、K+、NO3-、NH3·H2O
B.空气: C2H2、CO2、SO2、NO
C.氢氧化铁胶体: H+、K+、S2-、Br-
D.高锰酸钾溶液: H+、Na+、SO42-、葡萄糖分子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中,错误的是( )
A.向NaAlO2溶液中通入过量的CO2:
AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
B.向硫酸亚铁溶液中加入氯水:
2Fe2++Cl2=2Fe3++2Cl-
C.碳酸氢钡溶液中加入过量氢氧化钠溶液:
Ba2++2HCO3-+2OH-=BaCO3↓+2H2O+CO32-
D.Fe2O3溶于过量的氢碘酸:
Fe2O3+6H+=2Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能 大量共
大量共 存的是 ( )
存的是 ( )
A.0.1 mol·L-1 NaOH溶液:K+、Na+、SO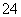 、CO
、CO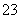
B.0.1 mol·L-1 Na2CO3溶液:K+、Ba2+、NO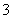 、Cl-
、Cl-
C.0.1 mol·L-1 FeCl3溶液:K+、NH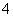 、I-、SCN-
、I-、SCN-
D.c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、NO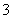
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)下面是用98%的浓H2SO4(ρ=1.84 g/cm3)配制成0.5 mol·L-1的稀H2SO4 500 mL的操作,请按要求填空:
①所需浓H2SO4的体积为________;
②如果实验室有15 mL、20 mL、50 mL量筒,应选用________mL的量筒最好;
③将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100 m L水的烧杯里,并不断搅拌,目的是________________________;
L水的烧杯里,并不断搅拌,目的是________________________;
④将________的上述溶液沿________注入________中,并用50 mL蒸馏水洗涤烧杯2~3次,洗涤液要一并注入上述容器中,并摇匀;
⑤加水至距刻度线1~2 cm时,改用________加水,使溶液的凹液面正好跟刻度线相切。
(2)某同学在配制NaOH溶液时有以下现象发生,则对所配溶液的物质的量浓度有何影响?(填“ 偏高”、“偏低”或“不变”)
偏高”、“偏低”或“不变”)
①定容时观察液面俯视________;
②NaOH颗粒表面部分变质________;
③用胶头滴管向容量瓶中加水时凹面高于刻度线,此时立即用胶头滴管将瓶内液体吸出,使凹液面与刻度线相切________。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的数值,下列说法不正确的是( )
A.常温下,1 L pH=1的硫酸溶液中含有的H+为0.1NA
B.常温下,14 g C2H4和C3H6的混合气体中含有2NA个氢原子
C.2.3 g Na和足量的O2完全反应,在常温和燃烧时,转移电子数均为0.1NA
D.1 mol甲醇中含有C—H键的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=__________
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=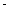 890.3 kJ·mol-1
890.3 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H=+2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=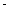 566.0 kJ·mol-1
566.0 kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H=________________[来源:全,品…中&高*考+网]
2CO(g)+2H2(g) 的△H=________________[来源:全,品…中&高*考+网]
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如右图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是_____________________
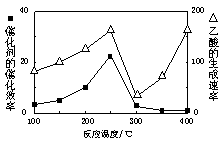
②为了提高该反应中CH4的转化率,可以采取的措施是________________________
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为___________________________
(3)Li2O、Na2O、MgO均能吸收CO2。①如果寻找吸收CO2的其他物质,下列建议合理的是______
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是___________________________
(4)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:
高温电解技术能高效实现(3)中反应A,工作原理示意图如下:

CO2在电极a放电的反应式是_____________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com