
| A. | 分散系中分散质粒子的大小:Fe(OH)3悬浊液<Fe(OH)3胶体<FeCl3溶液 | |
| B. | 焰色反应是物质燃烧时火焰呈现的颜色变化,属于化学变化 | |
| C. | 生石灰用作食品抗氧剂 | |
| D. | “海水淡化”可以解决“淡水供应危机”,但加入明矾不能使海水淡化 |
分析 A.分散系中分散质粒子的大小,浊液>胶体>溶液;
B.焰色反应是金属元素的特性,是金属元素的物理性质;
C.生石灰常做吸水剂,没有强还原性;
D.明矾可水解生成氢氧化铝胶体,具有吸附性.
解答 解:A.分散系中分散质粒子的大小:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液,故A错误;
B.焰色反应是金属元素的特性,是金属元素的物理性质,没有发生化学变化,故B错误;
C.生石灰常做吸水剂,没有强还原性,不能作食品抗氧剂,故C错误;
D.明矾可水解生成氢氧化铝胶体,具有吸附性,可除去水中的悬浮物而净化水,但不能使海水淡化,故D正确;
故选D.
点评 本题考查较为综合,题目难度不大,注意相关基础知识的积累即可解答该题,本题易错点为D,注意明矾净水的原理.


 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳原子间都以单链相连的链烃是烷烃 | |
| B. | 所有糖类物质都有甜味 | |
| C. | 油与脂肪都属于甘油酯 | |
| D. | 葡萄糖与果糖互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
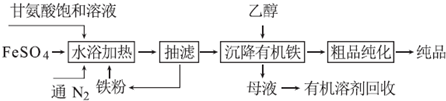
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
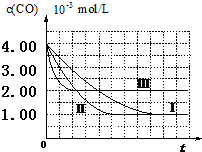 目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 6.50×10-3 | 120 | |||
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 6.50×10-3 | 4.00×10-3 | 80 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 问题 | 评价 |
| A | 用稀硝酸清洗做过银镜反应的试管 Ag+4H++NO3-=Ag++NO↑+2H2O | 错误,物质拆分错误 |
| B | 离子组 Na+、K+、HCO3-、OH- | 不能大量共存于同一溶液中,因为发生反应: HCO3-+OH-=H2O+CO2↑ |
| C | 反应: Cu2+(aq)+MnS(s)?CuS(s)+Mn2+(aq) | 该反应的平衡常数表达式:K=$\frac{{K}_{sp}(MnS)}{{K}_{sp}(CuS)}$ |
| D | 在硫酸氢钠溶于水的过程中 | 只有离子键被破坏没有共价键被破坏 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
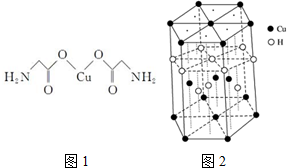
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的聚乙烯(PE)和乙烯完全燃烧消耗氧气的量相等 | |
| B. | 废弃的PE和PVC均可回收利用以减少白色污染 | |
| C. | 将PVC薄膜放入试管中加强热,产生的气体可使湿润的蓝色石蕊试纸变红 | |
| D. | PVC的单体可由PE的单体与氯化氢加成制得 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com