
分析 发生反应的化学方程式为:2Na+2H2O=2NaOH+H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑,根据n=$\frac{m}{M}$分别计算出铝、钠的物质的量,结合方程式计算出生成溶质充分及氢气的物质的量、质量,再根据质量守恒计算出反应后溶液质量,最后根据质量分数表达式计算出反应后所得溶液中溶质的质量分数.
解答 解:钠与水反应的方程式为2Na+2H2O=2NaOH+H2↑,Al与水氢氧化钠溶液反应的方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
2.7g铝的物质的量为:$\frac{2.7g}{27g/mol}$=0.1mol,2.3g钠的物质的量为:$\frac{2.3g}{23g/mol}$=0.1mol,
根据反应方程式可知,0.1mol钠与0.1mol铝恰好完全反应生成0.1mol偏铝酸钠和(0.05+0.15)mol=0.2mol氢气,
则反应后溶液质量为:100g+2.7g+2.3g-2g/mol×0.2mol=104.6g,
溶质偏铝酸钠的质量为:82g/mol×0.1mol=8.2g,
则反应后溶液中溶质的质量分数为:$\frac{8.2g}{104.6g}$×100%=7.8%,
答:充分反应后所得溶液中溶质的质量分数为7.8%.
点评 本题考查了化学方程式的计算、溶质质量分数的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握根据化学方程式进行计算的方法,试题培养了学生的分析能力及化学计算能力.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 若金属全部溶解,则溶液中一定含有Fe3+ | |
| B. | 若金属有剩余,向溶液中再滴入硫酸后,金属不会发生溶解 | |
| C. | 当溶液中金属离子只含有Fe3+、Cu2+时,则c与a、b的关系为:c=80a$\frac{1-b}{3}$ | |
| D. | 若金属全部溶解,且产生336mL气体(标准状况),则c=0.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
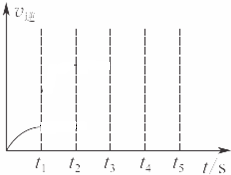 已知:3Fe(s)+4H2O(g)?Fe3O4(S)+4H2(g),某温度下其平衡常数k=1.在该温度时,在体积为5L的密闭容器中加入3mol Fe(s)与2mol H2O(g),t1秒时测得H2的物质的量为0.70mol.(计算时不用化简)
已知:3Fe(s)+4H2O(g)?Fe3O4(S)+4H2(g),某温度下其平衡常数k=1.在该温度时,在体积为5L的密闭容器中加入3mol Fe(s)与2mol H2O(g),t1秒时测得H2的物质的量为0.70mol.(计算时不用化简)查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | m=n | B. | m>n | C. | m<n | D. | m≤n |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
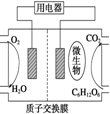 生物体中细胞膜内的葡萄糖,细胞膜外的富氧液体及细胞膜构成微型的生物原电池,下列有关判断正确的是( )
生物体中细胞膜内的葡萄糖,细胞膜外的富氧液体及细胞膜构成微型的生物原电池,下列有关判断正确的是( )| A. | 正极的电极反应式可能是O2+4e-═2O2- | |
| B. | 负极的电极反应式可能是O2+4e-+2H2O═4OH- | |
| C. | 正极反应主要是C6H12O6生成CO2或HCO3- | |
| D. | 负极反应主要是C6H12O6生成CO2或HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| B. | 25mL 0.3mol•L-1的FeBr2溶液中通入224mL标准状况下的氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| C. | 100mL 0.1mol•L-1的Al2(SO4)3溶液中加入20mL 3.5mol•L-1的NaOH溶液:Al3++4OH-═[Al(OH)4]- | |
| D. | 过量铁粉和稀硝酸反应:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com