
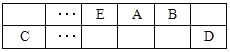
【题目】A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀或损坏。请回答下列问题:
(1)A元素的氢化物水溶液能使酚酞变红的原因用电离方程式解释为____________。
(2)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若所得溶液的pH=7,则a____b(填“>"或“<”或“=”)
(3)常温下,相同浓度F、G简单离子的溶液中滴加NaOH溶液,F、G两元素先后沉淀,F (OH)n完全沉淀的pH是4.7,G (OH)n完全沉淀的pH是2.8,则ksp较大的是:_______________填化学式)
(4)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有:________________。
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏
(5)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是________。
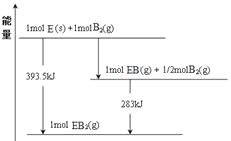
(6)已知一定量的E单质能在B2(g)中燃烧,其可能的产物及能量关系如下左图所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式__________。
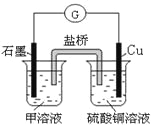
(7)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如上右图所示,其反应中正极反应式为_________________。
【答案】NH3·H2O![]() NH4++ OH- > Al(OH)3 ①③ Na3N + 4H2O=3NaOH + NH3·H2O CO2(g) + C(s) =2CO(g) △H= +172.5kJ/mol或
NH4++ OH- > Al(OH)3 ①③ Na3N + 4H2O=3NaOH + NH3·H2O CO2(g) + C(s) =2CO(g) △H= +172.5kJ/mol或![]() CO2(g) +
CO2(g) + ![]() C(s) =CO(g) △H=+86.25kJ/mol Fe3++e-=Fe2+
C(s) =CO(g) △H=+86.25kJ/mol Fe3++e-=Fe2+
【解析】
A、B、C、D、E、F是中学化学中常见的六种短周期元素,A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物,该离子化合物为铵盐,则A为N元素;C单质一般保存在煤油中,则C为Na;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,则F为Al;G单质是日常生活中用量最大的金属,易被腐蚀或损坏,则G为Fe;由元素在周期表中的相对位置可知,E为C元素、B为O元素,D为Cl元素,据此解答。
根据题意可推知:A是N;B是O;C是Na;D是Cl;E是C;F是Al;G是Fe,
(1)NH3的水溶液显碱性,能使酚酞变红,是因为在溶液中存在:NH3+H2O![]() NH3·H2O;故答案是: NH3·H2O
NH3·H2O;故答案是: NH3·H2O![]() NH4++ OH-;
NH4++ OH-;
(2)NH3+HCl=NH4Cl;若二者等体积混合,则恰好发生反应得到NH4Cl,该盐是强酸弱碱盐,水解使溶液显酸性,现在所得溶液的pH=7,溶液显中性,所以氨气要过量。因此a>b;
(3)Al(OH)3完全沉淀的pH是4.7,Fe(OH)3完全沉淀的pH是2.8,在离子浓度相同的情况下,加入NaOH时,Fe(OH)3先生成沉淀,结构相似的物质,ksp越小的,越易先生成沉淀,这说明kspAl(OH) 3>kspFe(OH) 3,因此ksp较大的是Al(OH)3;
(4)A与B可组成质量比为7:16的三原子分子NO2,该分子释放在空气中其化学作用可能引发的后果①酸雨;③光化学烟雾;
(5)A和C组成的一种离子化合物Na3N,能与水反应生成两种碱,该反应的化学方程式是Na3N + 4H2O=3NaOH + NH3·H2O.;
(6)由物质的能量及相互转化关系可得方程式为:CO2(g) + C(s) =2CO(g) ;△H= +172.5kJ/mol;
(7)若在Cl与Fe组成的某种化合物FeCl3的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,铜做负极,正极材料为石墨,所设计的原电池如上右图所示,其反应中正极反应式为Fe3++e-=Fe2+。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列实验的反应原理及对应的离子方程式均正确的是
A.室温下测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+
B.用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-=2AlO2-+H2↑
C.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
D.用酸性高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向FeCl3溶液中加入Na2SO3溶液,测定混合后溶液pH随混合前溶液中![]() 变化的曲线如图所示。
变化的曲线如图所示。
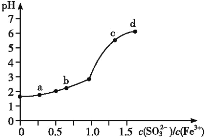
实验发现:
ⅰ.a 点溶液澄清透明,向其中滴加 NaOH 溶液后,立即产生灰白色沉淀,滴入 KSCN 溶液显红色;
ⅱ.c 点和 d 点溶液中产生红褐色沉淀,无气体逸出;取其上层清液滴加NaOH溶液后无明显现象,滴加 KSCN 溶液显红色。
下列分析合理的是
A.检验a点溶液中反应生成的阴离子所需试剂为:稀硝酸和BaCl2溶液
B.c点和d点出现上述现象的主要原因是Fe3+和![]() 发生双水解反应
发生双水解反应
C.b点较a点溶液pH升高的主要原因:2Fe3++![]() +H2O = 2Fe2++
+H2O = 2Fe2++![]() +2H+
+2H+
D.向d点上层清液中滴加 NaOH溶液无明显现象,证明溶液中无Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同情况下测得A(g)+3B(g)![]() 2C(g)+2D(s)的下列反应速率,其中反应速率最大的是
2C(g)+2D(s)的下列反应速率,其中反应速率最大的是
A.v(D)=0.8molL-1s-1B.v(C)=0.010 molL-1s-1
C.v(B)=0.6 molL-1min-1D.v(A)=0.2molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知丁烷在催化剂、加热、加压的条件下会以如下两种方式发生裂解:
①C4H10  CH4+C3H6
CH4+C3H6
②C4H10  C2H4+C2H6
C2H4+C2H6
现有1 mol丁烷,其中有36%以方式①裂解,有24%以方式②裂解,还有40%没有裂解,则最终所得混合气体的平均摩尔质量是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断下列离子方程式是否正确,错误的指明原因,并写出正确的离子方程式。____。
(1)铁粉溶于稀硫酸中:2Fe+6H+=2Fe3++3H2↑
(2)用三氯化铁溶液制取Fe(OH)3胶体:Fe3++3H2O=Fe(OH)3↓+3H+
(3)氢氧化铜溶于盐酸:OH-+H+=H2O
(4)氢氧化钡溶液与硫酸铜溶液混合:2OH-+Cu2+=Cu(OH)2↓
(5)铝与氯化铜溶液发生置换反应:Al+Cu2+=Al3++Cu
(6)硫酸溶液与氢氧化钡溶液混合:H++OH-+SO42-+Ba2+=BaSO4↓+H2O
(7)碳酸钙溶于硝酸溶液:CaCO3+2H+=Ca2++CO2↑+H2O
(8)碳酸氢钙溶液与足量氢氧化钠溶液混合HCO3-+OH-=CO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】DCCNa (二氯异氰尿酸钠)固体是一种高效、安全的消毒剂。20℃以上易溶于水。(CNO)3H3 (氰尿酸)为三元弱酸。
I.制备DCCA (二氯异氰尿酸)装置如图。主要反应有:
碱溶 (CNO)3H3+ 2NaOH=(CNO)3Na2H + 2H2O △H<0
氯化 (CNO)3Na2H +2Cl2=(CNO)3Cl2H + 2NaCl H<0
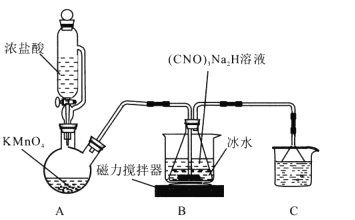
回答下列问题:
(1)装置C中的溶液是______________,作用为______________。
(2)装置A中反应的离子方程式为_______________。
(3)装置B用冰水浴的原因是__________, 碱溶时若氢氧化钠过量,(CNO)3Na2H中可能混有的杂质是__________。
Ⅱ.制备DCCNa
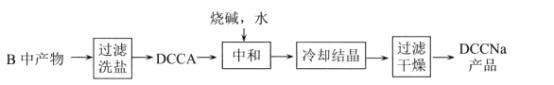
(4)步骤II中过滤洗盐”洗去的盐是__________________。
(5)“中和”反应的化学方程式为_________________。
(6)氧元素含量的测定:称取0. 1000 g DCNa样品,加入一定量醋酸溶液溶解,样品中的氯元素全邵转化成HClO,再加入足量的KI溶液,用淀粉作指示剂, 用01000 mol·L-1Na2S2O3标准溶液滴定生成的碘,消耗VmL.已知: I2+2S2O32-=2I-+S4O62-,样品中氯元素的质量分数=__________%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种锂铜可充电电池,工作原理如图。在该电池中,非水系电解液和水系电解液被锂离子固体电解质陶瓷片(LISICON)隔开。下列说法不正确的是
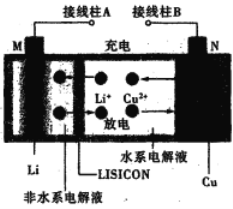
A. 陶瓷片允许Li+通过,不允许水分子通过
B. 放电时,N为电池的正极
C. 充电时,阴极反应为:Li+ +e-=Li
D. 充电时,接线柱A应与外接电源的正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Sorbicillin(简称化合物X)是生产青霉素时的一个副产品,其结构简式如下图所示。下列有关化合物X的说法不正确的是( )

A.分子中所有碳原子可能处于同一平面
B.1 mol化合物X可以与2 mol Na2CO3反应
C.化合物X可以发生加成、取代、氧化反应
D.化合物X与H2完全加成,每个产物分子中含有4个手性碳原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com