
(1)书写草酸(H2C2O4)使酸性KMnO4溶液褪色的化学方程式
(2)书写硫代硫酸钠与稀硫酸反应的离子方程式 .
考点:化学方程式的书写;离子方程式的书写.
分析:(1)锰元素化合价从+7价降低到+2价,KMnO4是氧化剂,被还原为Mn2+,两碳元素化合价共升高2价,草酸与酸性的高锰酸钾发生氧化还原反应,生成二氧化碳、锰离子和水;
(2)硫代硫酸钠与稀硫酸发生氧化还原反应,生成S、二氧化硫、水.
解答: 解:(1)草酸与酸性的高锰酸钾发生氧化还原反应,根据电子守恒,该反应中锰元素化合价降低5价,两碳元素化合价共升高2价,所以反应转移电子数为10,生成二氧化碳、锰离子和水,化学方程式为:2KMnO4+3H2SO4+5H2C2O4═K2SO4+2MnSO4+10CO2↑+8H2O;
故答案为:2KMnO4+3H2SO4+5H2C2O4═K2SO4+2MnSO4+10CO2↑+8H2O;
(2)硫代硫酸钠与稀硫酸发生氧化还原反应,生成S、二氧化硫、水,该反应为Na2S2O3+H2SO4=S↓+SO2↑+H2O+Na2SO4,离子反应为S2O32﹣+2H+=S↓+SO2↑+H2O,
故答案为:S2O32﹣+2H+=S↓+SO2↑+H2O.
点评:本题考查化学方程式、离子方程式的书写,明确物质性质是解本题关键,涉及氧化还原反应,注意硫代硫酸钠化学式的书写及S元素化合价,为易错点,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
我国材料科学家师昌绪在合金钢、高温合金及材料强度的研究领域作出了杰出贡献,荣获2010年度国家最高科学技术奖.
①合金是生活中常见的材料.某合金具有密度小、强度高的优良性能,常用于制造门窗框架.该合金中含量最高的金属为 (填元素符号).
②铁锈的主要成分是 (填化学式),它是钢铁在潮湿的空气中发生吸氧腐蚀的结果.
③玻璃是一种常用的硅酸盐材料.制备普通玻璃的原料有CaCO3、 和 (填化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
据环保部门测定,我国一些大城市的酸雨pH约为3.5.在酸雨季节铁制品极易腐蚀,下列说法正确的是( )
A.腐蚀中正极反应为:2H++2e﹣=H2↑
B.腐蚀中负极反应为:Fe﹣3e﹣=Fe3+
C.钢铁设备上连接铜块可以防止腐蚀
D.钢铁与外加直流电源的正极相连可以防止腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应:aA(g)+bB(s)⇌cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( )
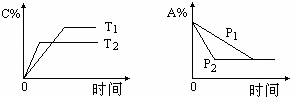
A.T1<T2 △H>0 B.T1>T2 △H<0
C.P1<P2 a=c+d D.P1<P2 a+b=c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇的研究成为当代社会的热点.
Ⅰ.甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.
(1)101kP a时,1mol CH3OH完全燃烧生成稳定的氧化物放出热量726.51kJ/mol,则甲醇燃烧的热化学方程式为 .
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0kJ•mol﹣1
②CH3OH(g)+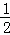 O2(g)=CO2(g)+2H2(g)△H2
O2(g)=CO2(g)+2H2(g)△H2
已知H2(g)+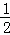 O2(g)=H2O(g)△H=﹣241.8kJ•mol﹣1
O2(g)=H2O(g)△H=﹣241.8kJ•mol﹣1
则反应②的△H2= kJ•mol﹣1.
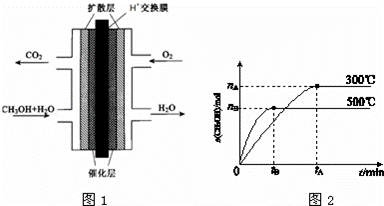
(3)甲醇燃料电池的结构示意图如图1.甲醇进入 极(填“正”或“负”),正极发生的电极反应为 .负极发生的电极反应为 .
Ⅱ.一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)⇌CH3OH(g)达到化学平衡状态.
(1)该反应的平衡常数表达式K= ;根据图2,升高温度,K值将 (填“增大”、“减小”或“不变”).
(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是 mol•L﹣1•min﹣1(用nB、tB表示).
(3)判断该可逆反应达到化学平衡状态的标志是 (填字母).
a.v生成(CH3OH)=v消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化
(4)300℃时,将容器的容积压缩到原来的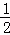 ,在其他条件不变的情况下,对平衡体系产生的影响是 (填字母).
,在其他条件不变的情况下,对平衡体系产生的影响是 (填字母).
a.c(H2)减少 b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加 d.重新平衡时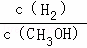 减小.
减小.
查看答案和解析>>
科目:高中化学 来源: 题型:
把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁:另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡.则原混合溶液中钾离子的物质的量浓度为( )
A. mol·L﹣1 B. mol·L﹣1
C. mol·L﹣1 D. mol·L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
亚硝酸钠是一种防腐剂和增色剂,但在食品中过量时会对人体产生危害.其在酸性条件下会产生NO和NO2.下列有关说法错误的是( )
A. NaNO2既具有氧化性又具有还原性
B. 食用“醋溜豆芽”可能会减少亚硝酸钠对人体的危害
C. NaNO2和胃酸作用的离子方程式为:2NO2﹣+2H+═NO↑+NO2↑+H2O
D. 1 mol NaNO2在酸性条件下完全反应生成NO和NO2,转移电子的物质的量为1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
化学中常用图像直观地描述化学反应的进程或结果。下列对图像的描述正确的是

A.根据图①可判断可逆反应A2(g)+3B2(g) 2AB3(g),正反应是吸热反应
2AB3(g),正反应是吸热反应
B.图②表示压强对反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
C.图③可表示乙酸溶液中通入氨气至过量的过程中溶液导电性的变化
D.根据图④可知,若除去CuSO4溶液中的Fe3+,可向溶液中加入CuO,调节pH在
4~5之间即可
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com