
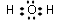 .
. 分析 (1)二氧化氮、氯气、过氧化钠均与水反应,发生氧化还原反应,但水既不是氧化剂也不是还原剂;
(2)水为共价化合物.
解答 解:(1)二氧化氮为红棕色气体、氯气为黄绿色气体、过氧化钠为淡黄色固体,均由短周期元素组成,三种物质均与水反应,发生氧化还原反应,但水既不是氧化剂也不是还原剂,发生的反应分别为3NO2+H2O=2HNO3+NO、Cl2+H2O=HCl+HClO、2Na2O2+2H2O=4NaOH+O2,
故答案为:3NO2+H2O=2HNO3+NO;Cl2+H2O=HCl+HClO;2Na2O2+2H2O=4NaOH+O2;
(2)水为共价化合物,只含H-O共价键,其电子式为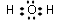 ,故答案为:
,故答案为: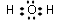 .
.
点评 本题考查无机物的推断,为高频考点,把握常见物质的性质、元素化合物知识为解答的关键,侧重分析与推断能力的考查,注意化学用语的使用,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 向待测溶液中加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,一定有CO32- | |
| B. | 向待测溶液中逐滴加入氢氧化钠溶液,开始有白色沉淀生成,继续滴加氢氧化钠溶液到过量,沉淀逐渐溶解,一定有 Al3+ | |
| C. | 向待测溶液中先滴加盐酸酸化未出现沉淀,再加入 BaCl2 溶液有白色沉淀产生,一定有SO42- | |
| D. | 向待测溶液中滴加 NaOH 溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,一定有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,将Cl2缓慢通入水中至饱和,然后向其中滴加0.1mol/LNaOH溶液.整个实验过程中溶液的pH变化曲线如图所示,不考虑次氯酸分解,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向其中滴加0.1mol/LNaOH溶液.整个实验过程中溶液的pH变化曲线如图所示,不考虑次氯酸分解,下列叙述正确的是( )| A. | 实验过程中用pH试纸测定溶液的pH | |
| B. | a~b段,溶液中 $\frac{c({H}^{+})}{c(O{H}^{-})}$ 减小 | |
| C. | b点对应溶液中:c(Cl-)>c(H+)>c(HClO)>c(ClO-)>c(OH-) | |
| D. | c点对应溶液中:c(Na+)=c(Cl-)+c(ClO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ②Na2O2
②Na2O2 ③N2
③N2 ④H2O
④H2O .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 | B. | 15 | C. | 20 | D. | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④③①⑤ | B. | ②③①④⑤ | C. | ②④③⑤① | D. | ②⑤③①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com