
 连二亚硫酸钠(Na2S2O4)俗称保险粉,具有强还原性,广泛用于纺织品漂白及作脱氧剂等.
连二亚硫酸钠(Na2S2O4)俗称保险粉,具有强还原性,广泛用于纺织品漂白及作脱氧剂等.

 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
| C |
| D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学利用如图装置,用0.1000mol/L的氢氧化钾溶液测定某未知浓度的盐酸溶液的物质的量浓度,其操作可分解为如下几步:
某同学利用如图装置,用0.1000mol/L的氢氧化钾溶液测定某未知浓度的盐酸溶液的物质的量浓度,其操作可分解为如下几步:| 实验次数 | c(KOH)/mol?L-1 | B中起点刻度 | B中终点刻度 | V(HCl)/ml |
| 1 | 0.1000 | 0 | 24.95 | 25.00 |
| 2 | 0.1000 | 0 | 24.96 | 25.00 |
| 3 | 0.1000 | 0 | 24.50 | 25.00 |
| 4 | 0.1000 | 0 | 24.94 | 25.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴定前标准液在零刻度以上 |
| B、盛未知浓度溶液的锥形瓶里有少量蒸馏水 |
| C、滴定管用蒸馏水冲洗后即注入标准液 |
| D、滴定终点读数时,俯视滴定管的刻度(其他操作均正确) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煮沸FeCl3饱和溶液易制备胶体 |
| B、豆浆制豆腐与胶体性质有关 |
| C、土壤的保肥作用与胶体性质有关 |
| D、胶体区别于其他分散系的本质特征是分散质粒子的大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
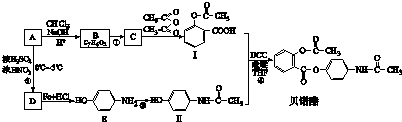
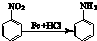
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com